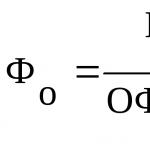Скорость ферментативной реакции, иными словами, активность фермента определяется также присутствием в среде активаторов и ингибиторов: первые повышают скорость реакции и иногда модифицируют ее, вторые - тормозят реакцию. Среди химических соединений, оказывающих влияние на активность ферментов, встречаются разнообразные вещества. Так, НС1 активирует действие пепсина, желчные кислоты - панкреатической липазы; некоторые тканевые ферменты (оксидоредуктазы, катепсины, аргиназа), растительная протеиназа папаин и др. в значительной степени активируются соединениями, содержащими свободные SH-группы (глутатион, цистеин), а некоторые также витамином С. Особенно часто в качестве активаторов служат (выступают) ионы двухвалентных и иногда одновалентных металлов. Многие ферменты вообще не активны в отсутствие металлов. Так, при удалении цинка угольная ангидраза практически лишена ферментативной активности; более того при действии этого фермента цинк не может быть заменен никаким другим металлом. Известны ферменты, действие которых активируется рядом металлов, в частности, енолаза (см. Углеводный обмен) активируется Mg 2+ , Mn 2+ , К + . В табл. 18 приведены примеры участия металлов в действии некоторых ферментов.
| Таблица 18. Металлы в активировании некоторых ферментов 1 (1 Обычно трудно провести границу между металлоферментами (металл связан комплексно н незаменим) и ферментами, активируемыми металлами (последние лишь ускоряют реакцию и легко диссоциируют). ) | |||
| Фермент | Металл | Фермент | Металл |
| Цитохромы | Fe | Амилаза | Са |
| Каталаза | Fe | Липаза | Са |
| Пероксидаза | Fe | Карбоангидраза | Zn |
| Триптофаноксидаза | Fe | Лактатдегидрогеназа | Zn |
| Гомогентизиказа | Fe | Уриказа | Zn |
| Аскорбатоксидаза | Си | Карбоксипептидаза | Zn |
| Тирозиназа | Си | Пептидазы | Mg |
| Фенолоксидаза | Си | Фосфатазы | Mg |
| Ксантиноксидаза | Мо | Фосфоглюкокиназа | Mg |
| Нитратредуктаза | Мо | Аргиназа | Mn |
| Альдегидоксидаза | Мо | Фосфоглюкомутаза | Mn |
| Пептидазы | Со | Холинэстераза | Mn |
Относительно роли металлов в активирующем действии ферментов имеющиеся данные свидетельствуют о том, что в ряде случаев ионы металлов (Со 2+ , Mg 2+ , Zn 2+ , Fe 2+) выполняют функции простетических групп ферментов. В других случаях они способствуют присоединению субстрата к активному центру и образованию фермент-субстратного комплекса. Например, ионы Mg 2+ через отрицательно заряженную фосфатную группу обеспечивают присоединение монофосфорных эфиров органических веществ к активному центру фосфатаз, катализирующих гидролиз этих соединений. В ряде случаев металл соединяется с субстратом, образуя истинный субстрат, на который действует фермент. В частности, ионы Mg 2+ активируют креатинфосфокиназу благодаря образованию истинного субстрата и магниевой соли АТФ. Наконец, имеются экспериментальные доказательства прямого участия металлов (например, ионов Са 2+ в молекуле амилазы слюны) в формировании и стабилизации активного центра и всей третичной структуры молекулы фермента. Следует отметить также нередкую роль мeталлов в качестве аллостерических модуляторов (см. рис. 59). Взаимодействуя с аллостерическим центром, подобный металл (модулятор) способствует образованию наиболее выгодной пространственной конфигурации фермента и активного фермент-субстратного комплекса.
Анионы при физиологических концентрациях обычно неэффективны или оказывают небольшое активирующее влияние на ферменты. Исключение составляют пепсин, некоторые оксидоредуктазы, активируемые анионами, а также слюнная амилаза, катализирующая гидролиз крахмала, активность которой повышается ионами хлора, и аденилатциклаза, которая активируется анионами галогенов.
Ингибиторами принято называть вещества, вызывающие частичное или полное торможение реакций, катализируемых ферментами. Поскольку ферменты являются белками, любые агенты, вызывающие денатурацию белка (нагревание, кислоты, щелочи, соли тяжелых металлов), приводят к инактивации фермента. Однако подобное инактивирование относительно неспецифично. Оно не связано с механизмом действия ферментов. Гораздо большую группу составляют так называемые специфические ингибиторы, которые оказывают свое действие на один какой-либо фермент или на группу родственных ферментов. Исследование этих ингибиторов имеет важное значение по ряду причин.
Во-первых, ингибиторы могут дать ценную информацию о природе активного центра фермента, а также его функциональных групп и химических связей, обеспечивающих образование фермент-субстратного комплекса. Известны вещества, специфически связывающие ту или иную группу в молекуле фермента, выключая ее из сферы химической реакции. В частности, йодацетат IСН 2 -СООН, его амид и этиловый эфир, парахлормеркурибензоат ClHg - С 6 Н 4 -СООН и другие реагенты сравнительно легко вступают в химическую связь с некоторыми SH-группами ферментов. Если такие группы существенны для акта катализа, то добавление подобных ингибиторов приводит к полной потере активности фермента:
R-SH + IСН 2 -СООН --> HI + R-S-СН 2 -СООН
Ряд других ферментов (холинэстераза, трипсин и химотрипсин) сильно тормозится некоторыми фосфорорганическими соединениями, в частности диизопропилфторфосфатом (ДФФ), вследствие блокирования ключевой гидроксильной группы сери-на в активном центре (см. выше).
Во-вторых, ингибиторы нашли широкое применение в энзимологии при исследовании природы множественных форм ферментов и изоферментов, отличающихся не столько по электрофоретической подвижности, сколько по различию реакций на один и тот же ингибитор.
При помощи ингибиторов, избирательно выключающих отдельные стадии многоступенчатого метаболического процесса, могут быть точно установлены последовательность химических реакций и природа участвующих ферментов. В частности, этим путем при применении йодацетата, фторида и других ингибиторов был расшифрован гликолитический путь окислительно-восстановительных превращений глюкозы до молочной кислоты в мышечной ткани (см. Обмен углеводов), насчитывающий 11 стадий с участием 11 ферментов и 10 промежуточных метаболитов.
На ингибировании ферментов основан механизм действия многих токсинов и ядов на организм. Так, известно, что при отравлениях синильной кислотой смерть наступает вследствие полного торможения дыхательных ферментов (цитохромоксидазы), в особенности клеток мозга. Токсическое влияние на организм человека и животных некоторых инсектицидов обусловлено торможением активности холинэстеразы - фермента, играющего первостепенную роль в деятельности нервной системы.
Рациональная химиотерапия - осознанное применение лекарственных препаратов в медицине, должна опираться на точное знание механизма их действия, на биосинтез ферментов или работу их в организме. Иногда метод лечения болезней человека включает применение избирательных ингибиторов. Так, ингибитор трипсина, химотрипсина и калликреина трасилол широко используется при лечении острого панкреатита. Избирательное ингибиторное действие на ферменты некоторых природных и синтетических соединений (так называемых антиметаболитов) в настоящее время служит основой для разработки эффективных методов синтеза химиотерапевтических препаратов. На этом пути открываются широкие возможности регуляции как синтеза ферментов, так и интенсивности метаболизма.
Типы ингибирования. Несмотря на то что механизм действия большинства ингибиторов не выяснен, обычно различают обратимое и необратимое ингибирование. Если молекула ингибитора вызывает стойкие изменения или модификацию функциональных групп фермента, то такой тип ингибирования называется необратимым. Чаще, однако, имеет место обратимое ингибирование, поддающееся количественному изучению на основе уравнения Михаэлиса - Ментен. Обратимое ингибирование в свою очередь разделяют на конкурентное и неконкурентное, в зависимости от того, удается или не удается преодолеть торможение ферментативной реакции путем увеличения концентрации субстрата. Во втором случае повышение концентрации субстрата не изменяет степень ингибирования фермента.
Конкурентное ингибирование может быть вызвано веществами, имеющими структуру, похожую на субстрат, но немного отличающуюся от структуры истинного субстрата. Классическим примером подобного типа ингибирования является торможение активности сукцинатдегидрогеназы малоновой кислотой. Этот фермент катализирует окисление путем дегидрирования янтарной кислоты в фумаровую в соответствии со схемой:
Если в среду добавить малоновую кислоту (ингибитор), то в силу структурного сходства ее с истинным субстратом янтарной кислотой (наличие двух таких же ионизированных карбоксильных групп) она будет реагировать с активным центром с образованием фермент-ингибиторного комплекса (см. схему), однако при этом перенос водорода от малоната не происходит. Так как структуры субстрата - янтарной кислоты и ингибитора - малоната все же несколько отличаются, они конкурируют за связывание с активным центром, и степень торможения будет определяться соотношением концентраций малоната и сукцината, а не абсолютной концентрацией ингибитора. Этот тип ингибирования иногда называют ингибированием по типу метаболического антагонизма (рис. 56).

В общей форме реакция взаимодействия ингибитора с ферментом может быть представлена следующим уравнением:
![]()
Образовавшийся комплекс, называемый фермент-ингибиторным комплексом (EI), в отличие от ES не распадается с образованием продуктов реакции. Константу диссоциации EI-комплекса или ингибиторную константу (K 1) можно, следуя теории Михаэлиса - Ментен, определить как отношение констант обратной и прямой реакций:
![]()
т. е. ингибиторная константа прямо пропорциональна произведению концентрации фермента и ингибитора и обратно пропорциональна концентрации ЕI-комплекса.
Метод конкурентного торможения нашел широкое применение в медицинской практике. Известно, например, что для лечения некоторых инфекционных заболеваний, вызываемых бактериями, применяют сульфаниламидные препараты. Оказалось, что эти препараты имеют структурное сходство с парааминобензойной кислотой, которую бактериальная клетка использует для синтеза фолиевой кислоты, являющейся составной частью ферментов бактерий. Благодаря этому структурному сходству сульфаниламид, например, блокирует действие фермента путем вытеснения парааминобензойной кислоты из комплекса с ферментом, синтезирующим фолиевую кислоту, что ведет к торможению роста бактерий.
Некоторые аналоги витамина В 6 и фолиевой кислоты, в частности дезоксипиридоксин и аминоптерин (см. Витамины), действуют как конкурентные, так называемые коферментные ингибиторы (или антивитамины), тормозящие многие биохимические процессы в организме.
Неконкурентное ингибирование вызывается веществами, не имеющими структурного сходства с субстратами и часто связывающимися не с активным центром, а в другом месте молекулы фермента. Степень торможения во многих случаях определяется продолжительностью действия ингибитора на фермент. При данном типе ингибирования благодаря образованию стабильной ковалентной связи фермент часто подвергается полной инактивации, и тогда торможение становится необратимым. Примерами неконкурентного ингибирования (инактивации) является действие йодацетата, диизопропилфторфосфата, а также диэтил-n-нитрофенилфосфата и синильной кислоты, заключающееся в связывании и выключении функциональных групп или ионов металлов в молекуле фермента.
Для выяснения вопроса о типе ингибирования пользуются уравнением Михаэлиса - Ментен, графиком Лайнуивера - Бэрка и другими более усовершенствованными уравнениями, например уравнением Эди - Хофсти:
v = - К m (0/[S]) + V mах
и соответствующими графиками в прямолинейных координатах. В приведенных ниже графиках, построенных в координатах v и [S], а также в координатах 1/v и 1/[S], V - максимальная скорость реакции, V 1 - максимальная скорость в присутствии ингибитора, К 1 - ингибиторная константа; все остальные символы были представлены выше.

Видно, что при конкурентном типе ингибирования (рис. 57) ингибитор увеличивает значение К m (на величину, равную разнице в длине отрезков, отсекаемых от оси абсцисс), не оказывая влияния на максимальную скорость. Это означает, что при достаточно высокой концентрации субстрата [S] ингибитор вытесняется молекулами субстрата из комплекса EI. При неконкурентном ингибировании (рис. 58) ингибитор снижает величину максимальной скорости. Если при этом величина К m не уменьшается, то говорят о полностью неконкурентном ингибировании. Подобный тип ингибирования имеет место при образовании неактивных, труднодиссоциирующих комплексов EI и (или) EIS. Часто, однако, имеет место смешанный тип ингибирования (иногда называемый частично неконкурентным типом), при котором снижение V mах сочетается с увеличением К m . Это означает, что комплекс EI сохраняет частичную активность, т. е. способность к образованию промежуточного тройного комплекса EIS, в котором субстрат подвергается замедленному каталитическому превращению. В редких случаях степень торможения активности фермента может увеличиваться с повышением концентрации субстрата; для этого типа торможения был предложен довольно неточный термин бесконкурентный (от англ. uncompetitive). Один из механизмов такого торможения обусловлен возможностью соединения ингибитора с комплексом ES с образованием неактивного или медленно реагирующего тройного комплекса ESI.
Таким образом, при графическом анализе скоростей ферментативных реакций как функции концентраций субстрата может быть получена ценная информация по кинетике ферментативных реакций, освещающая возможный механизм ферментативного катализа.
Регуляция активности ферментов
Выше было указано, что одним из уникальных свойств живых организмов является удивительная способность к сбалансированности катаболических (биодеградативных) и анаболических (биосинтетических) процессов. Хотя в клетках одновременно совершаются процессы синтеза, распада и взаимопревращения сотен и тысяч разнообразных веществ, имеется множество регуляторных механизмов, обеспечивающих постоянство внутренней среды организма. Некоторые из этих регуляторных механизмов, среди которых важная роль принадлежит механизмам регуляции активности ферментов, будут рассмотрены ниже.
Влияние закона действия масс. В катализируемой ферментом обратимой химической реакции, например A+B C+D, концентрация компонентов реакции и соответственно направление реакции будут регулироваться влиянием закона действия масс. Оно, в частности, может быть показано в обратимой реакции трансаминирования, катализируемой аланинаминотрансферазой:
Аланин + α-Кетоглутарат Пируват + Глутамат.
Этот тип регуляции играет, очевидно, лишь ограниченную роль, поскольку в реальных условиях реакция обычно протекает в одном направлении, так как образовавшиеся продукты могут оказаться субстратами для действия других ферментов и выводиться из сферы реакции; в этих случаях устанавливается скорее устойчивое (стационарное) состояние, чем истинное равновесие.
Изменение количества фермента. У бактерий хорошо изучен феномен индуцированного синтеза ферментов при выращивании их на среде, где единственным источником углерода и энергии служит тот или иной углевод, допустим, глюкоза. Замена глюкозы в среде на лактозу приводит к индуцированному или адаптированному (после небольшого периода лагфазы) синтезу фермента галактозидазы (программированному лактозным геном, см. Синтез белка), расщепляющей лактозу на глюкозу и галактозу. В животных тканях подобный быстрый синтез ферментов наблюдается сравнительно реже, и механизм, индуцирующий синтез, изучен только для небольшого числа ферментов (тирозинтрансаминазы, серин- и треониндегидратазы, триптофанпирролазы и др.). Однако при поступлении в организм некоторых ядов, канцерогенных веществ, алкалоидов, инсектицидов и др. наблюдается резкое увеличение через несколько дней активности (соответственно количества) ферментов - гидроксилаз гладкого эндоплазматического ретикулума клеток печени; окисляющих чужеродные вещества в нетоксичные для организма продукты. С другой стороны, описаны случаи, когда под действием подобных гидроксилаз чужеродные вещества превращаются в организме в более токсичные соединения. Это явление, обратное детоксикации, получило название летального синтеза.
Проферменты. Протеолитические ферменты желудочно-кишечного тракта и поджелудочной железы синтезируются в неактивной форме, в виде проферментов (зимогенов). Регуляция в этих случаях сводится к превращению проферментов в активные ферменты под влиянием специфических агентов. Так, трипсин синтезируется в поджелудочной железе в форме трипсиногена. Последний превращается в активный трипсин в кишечнике под действием другого белкового фермента - энтерокиназы, впервые открытого в лаборатории И. П. Павлова. Установлено, что активирующее действие энтерокиназы сводится к отщеплению от трипсиногена гексапептида, приводящему к формированию нативной третичной структуры трипсина и его активного центра (см. выше); наблюдается также аутокатализ. Превращение неактивного пепсиногена в активный пепсин осуществляется аутокаталитически в результате ограниченного протеолиза в присутствии НС1 и также связано с отщеплением от первого специфического ингибитора полипептидной природы (см. Обмен простых белков). Синтез протеиназ в неактивной форме и ряда других неактивных белков-предшественников имеет, очевидно, определенный биологический смысл, предотвращая разрушение клеток органов, в которых образуются проферменты.
Химическая модификация фермента. Выше было указано (см. Химия белков), что ряд белков при формировании третичной структуры подвергается постсинтетической модификации. Оказалось, что ключевые ферменты энергетического обмена - фосфорилаза, гликогенсинтетаза и др. - также контролируются путем фосфорилирования и дефосфорилирования, осуществляемого специфическими ферментами - протеинкиназой и протеинфосфатазой, уровень активности которых в свою очередь регулируется гормонами (см. Обмен углеводов). Уровень активности ключевых ферментов и соответственно интенсивность процессов обмена будут определяться соотношением фосфорилированных и дефосфорилированных форм этих ферментов.
Регуляция активности ферментов по принципу обратной связи. Во многих строго биосинтетических реакциях основным типом регуляции скорости многоступенчатого ферментативного процесса является ингибирование по принципу обратной связи, когда конечный продукт биосинтетической цепи подавляет активность фермента, катализирующего первую стадию.
Предположим, что в клетках осуществляется многоступенчатый биосинтетический процесс, каждая стадия которого катализируется собственным ферментом:

Скорость подобной суммарной последовательности реакций в значительной степени определяется концентрацией конечного продукта (Р), накопление которого выше допустимого уровня оказывает мощное ингибирующее действие на первую стадию процесса, соответственно на фермент E 1 .
Впервые существование подобного механизма контроля активности ферментов метаболитами было показано у Е. coli при исследовании синтеза изолейцина и цитидинтрифосфата (ЦТФ). Оказалось, что изолейцин, являющийся конечным продуктом, избирательно подавляет активность треониндегидратазы, катализирующей первое звено процесса превращения треонина в изолейцин, насчитывающего пять ферментативных реакций. Аналогично ЦТФ как конечный продукт биосинтетического пути оказывает ингибирующий эффект на первый фермент (аспартаттранскарбамоилазу), регулируя тем самым свой собственный синтез. Этот тип ингибирования получил название ингибирования по принципу обратной связи или ретроингибирования. Существование его доказано во всех живых организмах, и в настоящее время он рассматривается как один из ведущих типов регуляции активности ферментов и клеточного метаболиза в целом 1 . (1 Следует указать, что скорость реакции (как и активность ферментов) в чисто биодеградативных (катаболических) процессах регулируется промежуточными продуктами, являющимися индикаторами энергетического состояния клетки (пуриновые нуклеотиды, пирофосфат, неорганический фосфат и др.). )
С другой стороны, в амфиболических процессах (см. Введение в обмен веществ и энергии), выполняющих одновременно биосинтетические и биодеградативные функции 2 , доказано существование регуляции как по типу ретроингибирования, так и макроэргами - индикаторами энергетического состояния клетки. (2 К амфиболическйм процессам относят такие пути, как гликолиз, гликогенолиз, цикл трикарбоновых кислот, гексозомонофосфатный путь, трансаминирование аминокислот (см. Обмен веществ) ). Для амфиболических процессов уникальным типом регуляции, свойственным только им, является, кроме того, активация предшественником, когда первый метаболит в многоступенчатом пути активирует фермент, катализирующий последнюю стадию. Так, доказано активирующее влияние глюкозо-6-фосфата, являющегося предшественником гликогена, на фермент гликогенсинтетазу.
Подобные типы ингибирования конечным продуктом и активирования первым продуктом свойственны аллостерическим (регуляторным) ферментам (см. выше), когда эффектор, структурно отличаясь от субстрата, связывается в особом (аллостерическом) центре молекулы фермента, пространственно удаленном от активного центра. Поэтому принято различать аллостерический тип регуляции, включающий как аллостерическое ингибирование, так и аллостерическую активацию. Взаимопревращения активного и неактивного аллостерического фермента в упрощенной форме, а также конформационные изменения, наблюдаемые при присоединении субстрата и эффекторов, представлены на рис. 59.

Видно, что присоединение отрицательного эффектора к аллостерическому центру вызывает значительные изменения конфигурации активного центра молекулы фермента и как результат потерю сродства фермента к своему субстрату (образование неактивного комплекса).
Аллостерические взаимодействия проявляются в характере кривых зависимости начальной скорости реакции от концентрации субстрата или эффектора, в частности в S-образности кривых (отклонение от гиперболической кривой Михаэлиса - Ментен). Это означает, что связывание одной молекулы субстрата облегчает связывание второй молекулы у аллостерического центра, способствуя тем самым повышению скорости реакции. Кроме того, для регуляторных (аллостерических) ферментов характерна нелинейная зависимость скорости реакции от концентрации фермента.
Другие типы регуляции активности ферментов. Существует ряд других механизмов, контролирующих скорость метаболических процессов и активность внутриклеточных ферментов. К подобным механизмам могут быть отнесены конкуренция ферментов за общий субстрат, выключение активности одного из нзоферментов (у множественных форм ферментов), влияние концентраций кофакторов и их формы (в особенности ионов металлов) и явление компартментализации. Механизм компартментализации играет, по-видимому, важную биологическую роль, пространственно разъединяя посредством биомембран ферменты от своих субстратов (например, лизосомальные ферменты: протеиназы, фосфатазы, рибонуклеазы и другие гидролитические ферменты, от веществ, на которые они действуют в цитоплазме) или взаимно несовместимые в одно и то же время метаболические процессы. Примером последних могут быть пути синтеза жирных кислот, протекающие в основном в растворимой фракции цитоплазмы, и пути распада жирных кислот, сосредоточенные в митохондриях.
Определение активности ферментов
Определение количественного содержания ферментов в биологических объектах представляет известные трудности, поскольку, за редким исключением, ферменты в тканях присутствуют в ничтожно малых концентрациях. Поэтому о количестве ферментов судят по скорости катализируемой реакции, в определенных согласованных условиях измерения. При оптимальных условиях температуры, pH среды и полном насыщении фермента субстратом скорость пропорциональна концентрации фермента. О скорости ферментативной реакции судят или по скорости убыли субстрата, или по скорости образования продукта реакции.
Для выражения концентрации фермента Комиссией по ферментам Международного биохимического союза рекомендована стандартная единица (Е). За единицу любого фермента принимается то количество его, которое в оптимальных условиях катализирует превращение 1 мкмоль субстрата в минуту (мкмоль/мин). Предложено новое определение международной единицы фермента катал (кат, kat), соответствующее количеству фермента, способному вызывать превращение 1 моль субстрата в продукт в 1 с (1 моль/с). Отношение международной единицы (Е) к каталу можно выразить следующим образом:
или 1 Е=1 мкмоль · мин -1 = (1/60) мкмоль · с -1 = (1/60) мккат = 16,67 нкат. Таким образом, 1Е фермента соответствует 16,67 нкат.
Рекомендовано, кроме того, проведение измерения единиц фермента при 25°С, оптимуме pH и концентрации субстрата, превышающей концентрацию насыщения. В этих случаях скорость соответствует нулевому порядку реакции в отношении субстрата и будет зависеть только от концентрации фермента.
Для выражения активности фермента пользуются определением удельной и молекулярной активности. Удельную активность фермента принято выражать числом единиц ферментативной активности на 1 мг белка (или числом каталов на 1 кг активного белка). Число молекул субстрата, подвергающихся превращению одной молекулой фермента в минуту, принято называть числом оборотов, или молекулярной активностью. Так, одна молекула каталазы эритроцитов способна расщепить в 1 мин 5 · 10 6 молекул перекиси водорода 1 . (1 Для того чтобы 1 атом неорганического железа, также катализирующий распад Н 2 O 2 , расщеплял такое число молекул Н 2 O 2 , которое расщепляет каталаза в 1 с, потребовалось бы более 300 лет. Этот пример является наглядным доказательством одного из главных свойств ферментов - их высокой каталитической активности. )
Релаксационные методы основаны на том принципе, что при быстром внешнем воздействии на систему (изменение температуры, давления, пр.) время, которое нужно системе для достижения нового равновесия (или стационарного состояния), зависит от скорости химической реакции (и иногда от скорости диффузии реагентов.
Рассмотрим простейшую реакцию комплексообразования активного центра фермента с лигандом
В начале система
находится в равновесии, которое
характеризуется константой равновесия
K
0 =K
(T
0)
и соответственно равновесными
концентрациями ,
, ,
, .
Предположим, что в системе резко меняется
температураT
->T
0 +T
.
Это приводит к изменению константы
равновесияK
->K
0 +K
, которое определяется отношением
.
Предположим, что в системе резко меняется
температураT
->T
0 +T
.
Это приводит к изменению константы
равновесияK
->K
0 +K
, которое определяется отношением
 (2.50)
(2.50)
где H – стандартное изменение энтальпии. После этого система переходит в новое равновесное состояние:
 (2.51)
(2.51)
 (2.52)
(2.52)
Уравнение (2.51) нелинейно. Предположим, что отклонение от равновесия невелико и тогда
и уравнение (2.51) преобразуется в линейное дифференциальное уравнение:
Решение этого дифференциального уравнения:
Величина
 (2.54)
(2.54)
называется временем релаксации.
2.5. Влияние температуры и pH на скорость ферментативных реакций
Влияние этих факторов на скорость элементарной химической реакции было рассмотрено в Гл.1. Особенность состоит в том, что ферментативные реакции являются сложными многостадийными реакциями (состоящие из многих элементарных реакций). Кроме того, состояние молекул фермента в растворе характеризуется набором конформеров, обратимо переходящих друг в друга. Конформационные переходы молекулы определяются в значительной степени температурой и pHраствора.
2.6. Ингибирование ферментативных реакций
Вещества, подавляющие каталитическую активность ферментов, называются ингибиторами . Различают два основных класса ингибиторов –обратимые
 (2.55)
(2.55)
(пестициды, зарин, зоман, аспирин и др.)
и необратимые (инактиваторы )
 (2.55)
(2.55)
(окись углерода, цианид-ион, анальгин и др.)
2.7. Инактивация ферментов
Биополимерные молекулы (ферменты) являются термодинамически неустойчивыми и, как правило, с течением времени изменяют свою структуру и свойства. В большинстве случаев процесс инактивации может быть описан как переход между двуми состояниями фермента активного E a и неактивногоE i :
 (2.56)
Кинетика процесса описывается
соответствующим дифференциальным
уравнением
(2.56)
Кинетика процесса описывается
соответствующим дифференциальным
уравнением
 (2.57)
(2.57)
и характеризуется постоянной времени
 (2.58)
(2.58)
Процесс инактивации фермента может иметь различную физико-химическую природу. Наиболее общим является тепловая денатурация, представляющая собой существенную перестройку макромолекулы, изменение третичной и частично вторичной структуры.
Для целей инактивации могут быть использованы кавитационный ультразвук, радиоактивное излучение и пр.
Изменение pHтакже может привести к денатурации фермента. При каждом значенииpHбелок характеризуется соответствующим распределением зарядов (ионогенные группы). При очень низких или очень высокихpHраспределение зарядов может существенно поляризовать молекулу, приводить к появлению изомеров и необратимо конформировать ее с разрушением структуры активного центра. Например:

Денатурацию фермента вызывают и денатурирующие агенты , разрушающие вторичную структуру белка (например, мочевина), а также окислительные процессы с участием кислорода.
При изучении таких процессов важная информация получена релаксационными методами. Как правило, конформационные изменения сопровождаются изменением окружения ароматических аминокислот – тирозина и триптофана (полоса поглощения излучения на 290 нм). Это проявляется в изменении спектров поглощения и флуоресценции.
Обратимые конформационные изменения обычно идут со временем 0.1-100 мс, а необратимые – 1-1000 мин.
Пример 1. Простейшая кинетическая схема инактивации с равновесием конформеров:
 (2.59)
(2.59)
Кинетика процесса описывается одним характеристическим временем
 (2.60)
(2.60)
Пример 2. Инактивации подвержены оба конформера:
 (2.61)
(2.61)
 (2.62)
(2.62)
Пример 3. Более общий случай для системы с участиемn конформеров:
Часто ферменты в растворе образуют димеры, и в димерной форме оказываются стабильнее. Тогда наблюдается диссоциативный механизм инактивации :
 (2.65)
(2.65)
Следующая схема отражает возможные механизмы инактивации в процессе реакции (мономолекулярная инактивация свободной формы фермента, мономолекулярная инактивация фермен-субстратного комплекса, бимолекулярная инактивация фермента субстратом, бимолекулярная инактивация фермента продуктом):
 (2.66)
(2.66)
Дискриминация механизмов инактивации и определение кинетических характеристик реакции обычно проводится несколькими методами:
анализируя зависимость выхода продукта от концентрации фермента;
устанавливая связь степени конверсии субстрата со степенью инактивированности фермента;
проведение реакции при низких степенях конверсии субстрата и низких концентрациях фермента;
проведение реакции при больших концентрациях фермента;
предынкубация фермента с компонентами реакции;
использование интегральных уравнений реакции.
Haugaard в 1946 г. показал, что ферменты, активность которых зависит от присутствия восстановленных форм сульфгидрильных групп, необычно чувствительны к токсическому действию кислорода. В 1972 г. Tjioe, Haugaard пришли к выводу о связи инактивации таких ферментов при действии О2 под абсолютным давлением 5 кгс/см2 с исчезновением активных сульфгидрильных групп.
В легких у крыс под воздействием гипероксии (PiО2=5 кгс/см2) активность гидрогеназы и содержание сульфгидрильных групп были значительно снижены после 15-30 мин экспозиции, и при этом в тканях отмечали не макроскопические, а только небольшие микроскопические изменения. После 45 мин экспозиции наблюдали поражение легких и увеличение содержания бисульфидов.
Кроме ферментов , содержащих активные сульфгидрильные группы, под влиянием гипероксии, как известно, инактивируются многие другие ферменты. Возможно также, что потенциально активные радикалы могут вызывать необратимые поражения пептидных цепей и особенно аминокислот .
Пероксидация лнпидов
Взаимодействие ненасыщенных липидов с переокисленным анионом или с некоторыми другими свободными радикалами может вначале привести к высвобождению липидного радикала, а затем в результате самоокисления в присутствии кислорода образовать липидный пероксидный радикал . Дальнейшее взаимодействие перекиси липидов с другими липидами способно циклически регенерировать липидные свободные радикалы и перекисные соединения, вызывая тем самым цепную реакцию и прогрессирующее переокисление липидов.
Kovachich, Mishra (1980) показали, что переокисление липидов в срезах мозга крыс появляется даже во время экспозиции в условиях нормального давления воздуха с накоплением перекисных соединений в среде, так же как во внутриклеточной жидкости. Хотя вызванное действием кислорода переокисление липидов еще не продемонстрировано с определенной ясностью in vivo, в литературе имеются сообщения, что оно может иметь место в ткани мозга, эритроцитах, пузыре лягушки и в изолированном легком крысы.
В литературе имеется множество сообщений о том, что связанные с мембраной активные транспортные системы имеют тенденцию к инактивации под влиянием кислорода. Точно установлено, что потребление солей глутаминовой кислоты зависит от транспортной системы, связанной с переносом калия . В 1957 г. Kaplan, Stein на срезах коры головного мозга морских свинок, подвергнутых воздействию кислорода под абсолютным давлением 6 кгс/см2 в течение 90 мин, обнаружили как нарушение процессов потребления тканями солей глутаминовой кислоты, так и накопления калия.
Аналогичные закономерности были установлены в 1970 г. Joanny и сотрудниками на кортикальных срезах мозга, подвергнутых воздействию кислорода под абсолютным давлением в диапазоне 1-10 кгс/см2. Из литературных сообщений известно также о повреждениях активного транспорта натрия в препарате пузыря жабы и в изолированном лоскуте кожи лягушки под влиянием гипероксии. В 1973 г. Allen и сотрудники пришли к выводу, что наиболее вероятный механизм инактивации транспорта натрия под влиянием кислорода состоит в образовании промежуточных продуктов перекисей липидов.
На нарушение натриевого насоса мембраны клеток в кортикальных срезах, взятых у крыс, подвергнутых гипероксии под абсолютным давлением 4 кгс/см2, указывает наблюдаемое явление инактивации Na-K-АТФазы.
Усвоение как серотонива , так я вор-адреналина в изолированно перфузируемом препарате легких, взятом у крыс, подвергнутых действию кислорода под абсолютным давлением 1 кгс/см2, снижается . Оба этих изменения были значительными в пределах 12-24-часовой экспозиции, т. е. задолго до наступления структурных повреждений или появления клинических симптомов кислородного отравления легких.
Наоборот, клиренс имипрамина не изменялся в изолированных легких у крыс, которые дышали чистым кислородом при нормальном атмосферном давлении в течение около 48 ч . Полученные результаты согласуются с возможностью активного транспорта серотонина и норадреналина в эндотелиальных клетках легочных капилляров, в то время как удаление имипрамина происходит путем пассивного связывания . Кроме того, цитируемые авторы обнаружили, что токсическое влияние кислорода на мембрану эндотелиальных клеток распространяется либо не на один переносчик, либо на некоторые основные компоненты, вовлеченные в транспорт обоих аминов.
Одной из целей термической обработки является инактивация ферментов. Термическая устойчивость ферментов сравнима с устойчивостью микроорганизмов. По этой причине ферменты могут быть инактивированы с помощью тепловой обработки, как и в случае с микроорганизмами.
Во время пастеризации кислых продуктов, таких как квашенные овощи или фруктовые соки, следующие виды ферментов могут быть инактивированы: пектинметилстеараза и полигалактуроназа. Инактивация ферментов в этих продуктах более важна, чем разрушение микроорганизмов.
Некоторые виды ферментов очень термостабильны, например, теплоустойчивые ферменты, продуцируемые психрофильными бактериями. Эти ферменты (липазы и протеазы) могут ограничивать сроки хранения UHT-продуктов, таких как молоко.
Иногда интенсивность термических процессов основывается на инактивации определенных ферментов, которые называются индикаторными ферментами:
При бланшировании овощей: фермент пероксидаза (иногда каталаза или другие);
При пастеризации молока: фосфотаза или пероксидаза, эти индикаторные ферменты позволяют классифицировать молоко согласно интенсивности тепловой обработки (рисунок 2.9).
Рисунок 2.9 - Инактивация ферментов молока .
2.9 Оптимизация процессов термической обработки
Значения D и Z питательных веществ и показатели качества обычно выше, чем у микроорганизмов. Этот факт позволяет оптимизировать процесс тепловой обработки в сторону инактивации микроорганизмов и в то же время сохранения показателей качества.
Условия зависят от вида процесса, но в общем лучшие результаты дает интенсивный кратковременный тип процесса. В таблице 2.5 показаны потери витамина В 1 во время стерилизации.
Легко достичь оптимизации процесса стерилизации конвективно нагреваемых продуктов. Для жидкостей с маленькими частицами во взвешенном состоянии или без них лучшим решением является ультравысокотемпературная обработка.
Таблица 2.5 - Потери витамина В 1 во время стерилизации
2.10 Оценка значений F 0
Необходимое значение F 0 зависит от типа продукта и включает несколько факторов. Большое значение имеет рН продукта. Чем больше кислотность продукта, тем менее жестким будет режим стерилизации.
Различают 4 диапазона кислотности рН.
Помимо разрушения микроорганизмов значение рН также подразумевает:
Тепловая обработка менее интенсивная, если продукт имеет пониженную кислотность рН;
РН 4,5 имеет критическое значение: это самый низкий уровень рН, который допускает рост C.botulinum . Если значение рН больше, чем 4,5, выбранный процесс может привести к полной инактивации C.botulinum или 2,45 F 0 - 3 F 0 .
Значение рН 4,1 является самым низким для стерилизации. В диапазоне рН 4,1-4,5 применяется обработка 1 F 0 . При рН<4,1 нет необходимости проводить стерилизацию, т.к. пастеризация обеспечивает необходимый срок хранения и промышленную стерильность. Интенсивность процесса пастеризации часто определяется активностью ферментов, не микробиальной активностью.
Таблица 2.6 – Классификация консервов в соответствии с рН .
термофильные микро-организмы и харак-терные ферментыВсе воздействия, приводящие к инактивации ферментов, иногда условно подразделяют на физические и химические. К физическим относят нагревание или переохлаждение, облучение (у- и рентгеновское излучение), ультразвук, сорбцию на
границах раздела фаз (типа вода - воздух или жидкость -жидкость). Химическая инактивация может быть вызвана, например, щелочами к кислотами, поверхностно- активны ми веществами, органическими растворителями, мочевиной и гуанидин-хлоридом, некоторыми окислителями (например, кислородом или пероксидом водорода) и восстановителями (например, тиолами, ионами металлов), а также некоторыми ферментами (например, протеазами или протеинкиназами). Однако попытка классифицировать инактивационные процессы, основываясь на условном разделении инактивирующих воздействий на физические и химические, практически ничего не дает для понимания сути этих процессов. Так, например, под действием физического фактора (нагревания) в молекуле белка часто происходят химические изменения; окисление функциональных групп, гидролиз пептидных связей, С другой стороны, действие таких химических дена-турантов, как мочевина или гуанндин хлорид, как правило, вы-зывает изменения только физического состояния белка (конфор-мационные перестройки), но не меняет его химическую структуру.
Более информативной, с точки зрения решения стабилизационной задачи, является классификация инактивационных процессов по молекулярным механизмам.
§ 2. Молекулярные механизмы инактивации ферментов
Еще в 40-х - - начале 50-х годов сложились основные представления о механизмах инактивации. В наиболее общем случае инактивационный процесс можно представить в виде двухстадий-ной схемы:
где N, D и 1-соответственно нативная, обратимо денатурированная и необратимо инактнвированная формы белка*. Первая стадия на схеме (!) чаще всего представляет собой обратимое конформационное изменение; в случае олигомерных ферментов эта стадия состоит в обратимой диссоциации на субъединицы. Вслед за обратимыми процессами протекают необратимые стадии (D-Л)< Механизмы инактивации ферментов, как правило, классифицируют, исходя из природы процессов, происходящих именно на второй, необратимой стадии. Кратко рассмотрим основные ииактивационные механизмы.
Агрегация. Очень часто при длительной инкубации в растнорс при повышенной температуре, при экстремальных значениях pH t
* Термин <кнеобратимость» по ей ношению к инактивации имеет т\гт смысл, что после снятия инактиоанионншо воздействия (например, прн понижении температуры после 1фод<мжнтельн^го нагревания) фермент не втвращается h иатнвной каталитически активной информации N. Он остается в неактивной форме 1 и в течение разумных времен наблюдения (часы. с\тки) ш- списобен само произвольно реактивироваться, т, е. перейти в форму N,"
в присутствии химических денатурантов белки агрегируют. На возможность такой инактивации оказывает влияние целый ряд факторов: температура, рН и т. п.; однако решающим среди них является концентрация белка. Поскольку кинетический порядок уравнения, описывающего стадию агрегации, равен или даже больше двух, то, естественно, увеличение концентрации белка приводит к увеличению скорости агрегации и размеров образующихся агрегатов, а также ускорению инактивации в целом. По этому характерному признаку (сильная зависимость скорости инактивации от концентрации фермента в растворе) можно кинетически отличить агрегацию от мономолекулярных инактивационных механизмов.
Как правило, белковые агрегаты образуются за счет слабых нековалентных взаимодействий, таких, как гидрофобные взаимодействия, водородные связи. Однако если в молекулах белков имеются SH-группы или дополнительно к ним еще S-8-связи т то отдельные молекулы внутри агрегатов могут сшиваться ко-валентными дисульфидными мостиками. Размер и форма некова-лентных или ковалентпо-сшитых агрегатов могут изменяться в широких пределах вплоть до образования отдельной фазы - белковых осадков.
Изменение первичной структуры. Все химические процессы, приводящие к инактивации белков, можно подразделить на две группы. К первой относятся реакции разрыва пол и пептидной це-почки т ко второй - химическая модификация отдельных функциональных групп белка.
Гидролиз пептидных связей, протеолиз и автолиз. Не каталитическое растепление пептидных связей проходит в очень-жестких условиях. Так, полного расщепления полипептидной цепи на отдельные составляющие аминокислоты добиваются лишь путем длительного (многочасового) кипячения раствора белка в концентрированной соляной кислоте. В несколько более «мягких» условиях, при нагревании белковых растворов при нейтральных или слабощелочных рН и температуре 80-100°С, гидролиз пептидных связей либо проходит лишь незначительно, либо его вообще не наблюдается. Из всех пептидных связей наиболее лабильными к высокотемпературному гидролизу, как правило, оказываются те, которые образованы остатками аспарагиновой кислоты.
Однако гидролиз пептидных связей в белках может происходить и при нормальных условиях - комнатной температуре, нейтральных значениях рН. Это является результатом работы протеаз - ферментов, созданных природой для деградации других белков в мягких условиях. Поскольку в любых (даже высоко-очищенных) препаратах белков могут находиться протеазы в качестве сопутствующих примесей, при изучении механизмов инактивации необходимо учитывать и возможность протеолиза. ф Другим примером протеолитической инактивации может служить бактериальное заражение реакторов, содержащих ферменты. Случайно попавшие в реактор клетки микроорганизмов
Секретируют протеазы, которые расщепляют молекулы фермента-биокатализатора, находящегося в растворе. Используя «осколки» протеолитической деградации в качестве питательной среды для роста, микроорганизмы размножаются; тем самым они, с одной стороны, «засоряют» реактор, с другой - уменьшают активность биокатализатора в растворе, т. е. инактивируют его.
Сами протеолитические ферменты способны расщеплять не только молекулы других белков, но и себе подобные- Этот процесс «саморасщепления» протеаз получил название автолиз а. От большинства других инактивационных механизмов (за исключением агрегации) автолиз можно отличить кинетически. Дело в том, что существенной стадией при автолизе является образование комплекса между двумя молекулами п роте азы; эта бимолекулярная стадия часто определяет общую скорость инактивации. Поэтому, если при изменении начальной концентрации протеаяы наблюдается изменение скорости инактивации* то изучаемый ннактивационный процесс с большой вероятностью представляет собой автолиз.
Окисление функциональных групп фермента. При повышенных температурах некоторые функциональные группы в белках, и в первую очередь SH-группы цистеина и индольные фрагменты триптофана, окисляются. В результате окисления образуются модифицированные производные аминокислот; сульфоксисоеди-нения цистеина (SOH, SCW и т. д.), продукты раскрытия ин-дольного кольца триптофана и др. В некоторых ферментах сульф-гидрильные группы, входящие в состав активного центра, обладают повышенной реакционной способностью и окисляются даже при комнатной температуре.
Расщепление S-S-связей в белках. Расщепление может происходить либо в восстановительной среде (в присутствии тиолов, других восстановленных соединений серы, например ЫагЭОз, NaACbh либо в щелочной среде при повышенной температуре. В первом случае продуктом восстановления S-S-связи является ее тиольная форма {белок -SH) либо смешанный дисульфид тиольной формы белка с восстанавливающим реагентом (белок -S-S-R; белок -S-SOr и т. п,). При щелочном расщеплении S-S-связей пр!оисходит более сложная цепь химических реакций. Сначала цистин гидролизуется с образованием дегидро-аланина:
i-СНг-СН<^ + ОН ~ -* ЧСН-CH^S-S~ + СН г = С
который, как нуклеофил, взаимодействует с аминогруппами остатков лизина, сульфгидрильными группами остатков цистеина, гуанидиниевыми группами остатков аргинина, образуя новые аминокислоты, соответственно, лизиноаланин, лантионин н орни-тниоаланин:
соон ч хоон