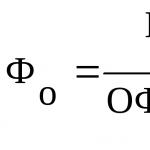Фундаментальной опорой химии, наравне с периодической системой Д. И. Менделеева, строением органических соединений А. М. Бутлерова, другими значимыми открытиями, является и теория электролитической диссоциации. В 1887 году она была разработана Сванте Аррениусом для объяснения специфического поведения электролитов в воде, других полярных жидкостях и расплавах. Он нашёл компромисс между двумя категорически разными, существующими на то время теориями о растворах - физической и химической. Первая утверждала, что растворённое вещество и растворитель никак друг с другом не взаимодействуют, образуя простую механическую смесь. Вторая, что между ними происходит химическая связь. Оказалось, что на самом деле растворам присущи и те, и другие свойства.
В последующих этапах развития науки многие учёные продолжали исследования и разработки в этой области, опираясь на имеющиеся сведения о строении атомов и природе химических связей между ними. В частности И. А. Каблуков занимался вопросом сольватационных процессов, В. А. Кистяковский определил зависимость поднятия столба жидкости в капилляре в условиях температуры кипения от молекулярного веса.
Современная трактовка теории
До появления данного открытия многие свойства и обстоятельства процессов расщепления были не изучены, как и сами растворы. Электролитическая диссоциация - это процесс распада вещества на составляющие его ионы в воде или других полярных жидкостях, взаимодействия частиц соединения с молекулами растворителя, появления подвижности катионов и анионов в узлах кристаллической решетки из-за расплавления. В результате этого образованные субстанции получают новое свойство - электрическую проводимость.
Ионы, находясь в свободном состоянии раствора или расплава, взаимодействуют между собой. Одноимённо заряженные отталкиваются, разноименные - притягиваются. Заряженные частицы сольватированы молекулами растворителя - каждая плотно окружена строго ориентированными диполями соответственно силам притяжения Кулона, в частном случае гидратированы, если среда водная. Катионы всегда имеют большие радиусы, чем анионы из-за специфики расположения вокруг них частиц с локализованными по краям зарядами.
Состав, классификация и названия заряженных частиц в свете электролитической диссоциации
Ионом называют атом или группу атомов, которые являются носителями положительного или отрицательного заряда. Им присуще условное подразделение на простые (К (+) , Са (2+) , Н (+) - состоящие из одного химического элемента), сложные и комплексные (ОН (-) , SO 4 (2-) , НСО 3 (-) - из нескольких). Если катион или анион связан с молекулой растворителя, он называется сольватированным, с диполем молекулы Н 2 О - гидратированным.
Когда происходит электролитическая диссоциация воды, образуется две заряженные частицы Н (+) и ОН (-) . Протон водорода принимает на вакантную орбиталь неподелённую электронную пару кислорода из другой молекулы воды, в результате чего образуется ион гидроксония Н 3 О (+) .
Основные положения открытия Аррениуса
Все представители классов неорганических соединений, кроме оксидов, в растворах ориентированных диполей жидкостей распадаются, говоря химическим языком - диссоциируют на составляющие их ионы в большей или меньшей степени. Наличия электрического тока этот процесс не требует, уравнение электролитической диссоциации является его схематической записью.
Попадая в раствор или расплав, ионы могут подвергаться действию электрического тока и направленно двигаться к катоду (отрицательному электроду) и аноду (положительному). Последние притягивают противоположно заряженные атомные агрегаты. Отсюда частицы и получили свои названия - катионы и анионы.

Параллельно и одновременно с распадом вещества идёт обратный процесс - ассоциация ионов в исходные молекулы, поэтому стопроцентного растворения вещества не происходит. Такое уравнение реакции электролитической диссоциации содержит знак равенства между правой и левой его частями. Электролитическая диссоциация, как любая другая реакция, подчиняется законам, регулирующим химическое равновесие, не является исключением и закон действующих масс. Он гласит, что скорость процесса распада на ионы пропорциональна концентрации электролита.
Классификация веществ при диссоциации
Химическая терминология подразделяет вещества на нерастворимые, малорастворимые и растворимые. Два последних - это слабые и сильные электролиты. Сведения о растворимости тех или иных соединений сведены в таблицу растворимости. Диссоциация сильных электролитов - это необратимый процесс, они нацело распадаются на ионы. Слабые - лишь частично, им присуще явление ассоциации, а следовательно, равновесность происходящих процессов.

Важно отметить, что прямой зависимости между растворимостью и силой электролита нет. У сильных она может быть слабо выражена. Так же как и слабые электролиты могут быть хорошо растворимы в воде.
Примеры соединений, растворы которых проводят электрический ток
К классу «сильные электролиты» относят все хорошо диссоциирующие кислоты, такие как азотная, соляная, бромная, серная, хлорная и другие. В одинаковой степени и щёлочи - гидроокислы щелочных и отдельные представители группы «щелочноземельные металлы». Интенсивна электролитическая диссоциация солей, кроме определённых цианатов и тиоцианатов, а также хлорида ртути (II).
Класс «слабые электролиты» представляют остальные минеральные и почти все органические кислоты: угольная, сульфидная, борная, азотистая, сернистая, кремниевая, уксусная и другие. А также малорастворимые и углеводородные основания и амфотерные гидроксиды (гидроокиси магния, бериллия, железа, цинка в степени окисления (2+)). В свою очередь, молекулы воды являются очень слабыми электролитами, но всё же распадаются на ионы.
Количественное описание диссоциирующих процессов
Степень электролитической диссоциации фактически характеризует масштабы процесса расщепления. Её можно вычислить - число расщепившихся на ионы частиц необходимо разделить на общую численность молекул растворённого вещества в системе. Обозначают эту величину буквой «альфа».

Логично, что для сильных электролитов «α» равна единице, или ста процентам, так как число распавшихся частиц равно общему их количеству. Для слабых - всегда меньше единицы. Полного распада исходных молекул на ионы в водной среде не происходит, и идёт обратный процесс.
Главные факторы, влияющие на полноту распада
На степень электролитической диссоциации влияет ряд неоспоримых факторов. В первую очередь важна природа растворителя и вещества, распадающегося в нём. Например, все сильные электролиты имеют ковалентный сильно полярный или ионный тип связи между составными частицами. Жидкости представлены диполями, в частности вода, в молекулах имеется разделение зарядов, и в результате их специфической ориентации происходит электролитическая диссоциация растворённого вещества.
На значение «альфа» обратно пропорционально влияет концентрация. При её увеличении значение степени диссоциации уменьшается, и наоборот. Сам процесс всецело эндотермический, то есть для его инициации необходимо определённое количество теплоты. Влияние температурного фактора обосновано так: чем он выше, тем больше степень диссоциации.
Второстепенные факторы
Многоосновные кислоты, такие как фосфорная, и основания в составе с несколькими гидроксильными группами, например, Fe(ОН) 3 , распадаются на ионы ступенчато. Определена зависимость - каждая последующая стадия диссоциации характеризуется степенью, которая в тысячи или десятки тысяч раз меньше предыдущей.

Изменить степень распада может и добавление в систему других электролитов, изменяющих концентрацию одного из ионов основного растворённого вещества. Это влечёт за собой смещение равновесия в сторону, которое определяется правилом Ле Шателье-Брауна - реакция протекает в том направлении, в котором наблюдается нейтрализация влияния, оказанного на систему извне.
Классическая константа равновесного процесса
Для характеристики процесса распада слабого электролита, помимо его степени, применяется константа электролитической диссоциации (К д), которая выражается отношением концентраций катионов и анионов к количественному содержанию в системе исходных молекул. По сути, она является обычной постоянной химического равновесия для обратимой реакции расщепления растворённого вещества на ионы.
Например, для процесса распада соединения на составляющие его частицы константа диссоциации (К д) будет определяться частным постоянных концентраций катионов и анионов в составе раствора, возведённых в степени, соответствующие цифрам, стоящим перед ними в химическом уравнении, и общего числа оставшихся не продиссоциировавших формульных единиц растворённого вещества. Прослеживается зависимость - чем выше (К д), тем больше число катионов и анионов в системе.
Связь концентрации слабого распадающегося соединения, степени диссоциации и константы определяется с помощью закона разведения Оствальда уравнением: К д = α 2 с.
Вода как слабо диссоциирующее вещество
Дипольные молекулы в крайне небольшой степени распадаются на заряженные частицы, так как это энергетически невыгодно. Всё же идёт расщепление на катионы водорода и гидроксильные анионы. С учётом гидратационных процессов можно говорить об образовании из двух молекул воды иона гидроксония и ОН (-) .

Постоянная диссоциация определяется отношением произведения протонов водорода и гидроксидных групп, называемого ионным произведением воды, к равновесной концентрации не распавшихся молекул в растворе.
Электролитическая диссоциация воды обуславливает наличие в системе Н (+) , которые характеризуют её кислотность, а присутствие ОН (-) - основность. Если концентрации протона и гидроксильной группы равны, такая среда называется нейтральной. Существует так называемый водородный показатель - это отрицательный логарифм от общего количественного содержания Н (+) в растворе. рН меньше 7 говорит о том, что среда кислая, больше - о её щелочности. Это очень важная величина, по её экспериментальному значению анализируют биологические, биохимические и химические реакции различных водных систем - озёр, прудов, рек и морей. Неоспорима также актуальность водородного показателя для промышленных процессов.
Запись реакций и обозначения
Уравнение электролитической диссоциации с помощью химических знаков описывает процессы распада молекул на соответствующие частицы и называется ионным. Оно в разы проще стандартного молекулярного и имеет более общий вид.

При составлении такого уравнения нужно учитывать, что вещества, осаждающиеся или удаляющиеся из реагирующей смеси в составе паров газа в ходе реакции, всегда необходимо записывать только в молекулярной форме, в отличие от соединений электролитов, сильные представители которых только в расщепившемся на ионы виде входят в состав растворов. Электролитическая диссоциация для них - необратимый процесс, так как ассоциация невозможна в силу образования не расщепляющихся веществ или газов. Для такого типа уравнения действуют те же правила, что и для прочих химических реакций - суммы коэффициентов левых и правых частей обязательно должны быть равны друг другу для соблюдения материального баланса.
Электролитическая диссоциация кислот и оснований может идти в несколько стадий, если вещества многоосновные или многокислотные. Для каждой подреакции записывается своё уравнение.
Роль в химической науке и её развитии
Величайшее значение создание теории Сванте Аррениуса имело для общего процесса становления физической и, в частности, электрохимической науки. На основе открытия такого явления, как электролитическая диссоциация, интенсивное развитие получили электродные процессы, специфика прохождения токов через различные среды, теория наведения катодно-анодных потенциалов. Кроме этого, значительно продвинулась вперёд теория растворов. Небывалые открытия ждали и химическую кинетику, область коррозии металлов и сплавов, а также работы по поиску новых средств защиты от неё.
В современном мире ещё так много нового и неизвестного. С каждым днём учёные продвигаются всё дальше в познании такой великой дисциплины, как химия. Электролитическая диссоциация, а также её создатели и последователи навсегда заняли почётное место в контексте развития мировой науки.
Распад молекул электролита на ионы под действием полярных молекул растворителя называется электролитической диссоциацией . Вещества, водные растворы или расплавы которых проводят электрический ток, называются электролитами.
К ним относятся вода, кислоты, основания и соли. При растворении в воде молекулы электролитов диссоциируют на положительные ионы – катионы и отрицательные – анионы . Процесс электролитической диссоциации обусловлен взаимодействием веществ с водой или другим растворителем, что приводит к образованию гидратированных ионов.
Так, ион водорода образует ион гидроксония:
Н+ + Н2О « Н3О+.
Для упрощения ион гидроксония записывают без указания молекул воды, то есть Н+.
NaCl + nH2O ® Na+(H2O)x + Cl–(H2O)n-x,
или принята запись: NaCl « Na+ + Cl–.
Диссоциация кислот, оснований, солей
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода. Например,
HNO3 « H+ + NO3–
Многоосновные кислоты диссоциируют ступенчато. Например сероводородная кислота диссоциирует ступенчато:
H2S « H+ + HS– (первая ступень)
HS– « H+ + S2– (вторая ступень)
Диссоциация многоосновных кислот протекает, главным образом, по первой ступени. Это объясняется тем, что энергия, которую нужно затратить для отрыва иона от нейтральной молекулы, минимальна и становится больше при диссоциации по каждой следующей ступени.
Основаниями называются электролиты, диссоциирующие в растворе, которые в качестве анионов образуют только гидроксид-ионы. Например,
NaOH ® Na+ + OH–
Многокислотные основания диссоциируют ступенчато
Mg(OH)2 « MgOH+ + OH– (первая ступень)
MgOH+ « Mg2+ + OH– (вторая ступень)
Ступенчатая диссоциация кислот и оснований объясняет образование кислых и основных солей.
Существуют электролиты, которые диссоциируют одновременно как основные и как кислотные. Они называются амфотерными.
H+ + RO– « ROH « R+ + OH–
Амфотерность объясняется малым различием прочности связей R–H и О–Н.
К амфотерным электролитам относятся вода, гидроксиды цинка, алюминия, хрома (III), олова (II, IV), свинца (II, IV) и др.
Диссоциацию амфотерного гидроксида, например Sn(OH)2, можно выразить уравнением:
2H+ + SnO22– « Sn(OH)2 « Sn2+ + 2OH–
2H2O ¯ основные свойства
2H+ + 2–
кислотные свойства
Солями называют электролиты, которые при диссоциации образуют катионы металлов, или комплексные катионы, и анионы кислотных остатков, или комплексные анионы.
Средние соли, растворимые в воде, диссоциируют практически полностью
Al2(SO4)3 « 2Al3+ + 2SO42–
(NH4)2CO3 « 2NH4+ + CO32–
Кислые соли диссоциируют ступенчато, например:
NaHCO3 « Na+ + HCO3– (первая ступень)
Анионы кислых солей в дальнейшем диссоциируют незначительно:
HCO3– « H+ + CO32– (вторая ступень)
Диссоциацию основной соли можно выразить уравнением
CuOHCl « CuOH+ + Cl– (первая ступень)
CuOH+ « Cu+2 + OH– (вторая ступень)
Катионы основных солей по второй ступени диссоциируют в незначительной степени.
Двойные соли – это электролиты, которые при диссоциации образуют два типа катионов металла. Например
KAl(SO4)2 « K+ + Al3+ + 2SO42–.
Комплексные соли – это электролиты, при диссоциации которых образуются два типа ионов: простой и комплексный. Например:
Na2 « 2Na+ + 2–
Количественной характеристикой электролитической диссоциации является степень диссоциации a , равная отношению числа молекул, распавшихся на ионы (n), к общему числу растворенных молекул (N)
Степень диссоциации выражается в долях единицы или процентах.
По степени диссоциации все электролиты делятся на сильные (a>30%), слабые (a<3%) и средней силы (a - 3-30%).
Сильные электролиты при растворении в воде полностью диссоциируют на ионы. К ним относятся:
|
HCl, HBr, HJ, HNO3, H2SO4, HClO3, HClO4, HMnO4, H2SeO4 |
|
|
Основания |
NaOH, KOH, LiOH, RbOH, CsOH, Ba(OH)2, Ca(OH)2, Sr(OH)2 |
|
растворимые в воде (приложение, табл.2) |
ЛАБОРАТОРНАЯ РАБОТА 3
ЭЛЕКТРОЛИТЫ
Цель работы : изучение химических свойств сильных и слабых электролитов.
Задачи работы : установить смещение ионного равновесия в растворах слабых электролитов; научиться составлять ионно-молекулярные реакции обмена в растворах электролитов.
Реактивы : CH 3 COONa (тв.) , NaCl (тв.) , растворы: HCl (0,1 М), CH 3 COOH (0,1 М), H 2 SO 4 , Pb(NO 3) 2 , K 2 CrO 4 , BaCl 2 , Na 2 SO 4 , CuSO 4 , NiSO 4 , Na 2 CO 3 , NH 4 Cl, NaOH (конц.) , метиловый оранжевый; дополнительно: NH 4 OH (разб.) , NH 4 OH (конц.) .
Оборудование: пробирки, пипетки.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Неорганические вещества, растворы которых проводят электрический ток, называют электролитами. Растворы многих органических веществ (сахар, спирты) не проводят электрический ток и являются неэлектролитами.
Термин «электролиты» ввел Фарадей, который считал, что проводимость растворов обусловлена распадом веществ в электрическом поле (в переводе с греческого электролит означает «разлагаемый электричеством»). Однако, в конце XIX в. С. А. Аррениус на основании свойств растворов ∆Т зам , ∆Т кип , P осм (законы Рауля, Вант-Гоффа) показал, что распад происходит вне поля – на стадии растворения веществ. Аррениус является автором основ теории электролитической диссоциации.
Современная теория растворов (в ее разработке участвовали И. А. Каблуков, Д. И. Менделеев) основывается на решающей роли растворителя (полярных молекул воды) в диссоциации. Процесс появления гидратированных ионов в водных растворах называется электролитической диссоциацией .
Электролиты – это вещества, которые диссоциируют (распадаются) на ионы. Ионы в растворах не свободны, а образуют с водой непрочные соединения – гидраты. К электролитам относятся кислоты, основания, соли и комплексные соединения.
Чтобы объяснить различия свойств (электропроводность и другие) у электролитов и неэлектролитов Аррениус ввел понятия степени диссоциации и силы электролитов. Степень диссоциации электролита α – это доля молекул, распадающихся на ионы. По величине степени диссоциацииэлектролиты делятся на сильные и слабые (иногда выделяют электролиты средней силы).
Сильные электролиты (α ≈ 1 или 100 %) в растворах практически полностью диссоциируют на ионы. Растворы состоят только из ионов (точнее гидратов ионов). Этот процесс необратим. К сильным электролитам относятся:
Кислоты: HCl, HBr, HI, HNO 3 , HClO 3 , HClO 4 , H 2 Cr 2 O 7 , HMnO 4 , H 2 SO 4 ;
Основания (щелочи): LiOH, NaOH, KOH, Ca(OH) 2 , Ba(OH) 2 , Sr(OH) 2 ;
Соли: почти все;
Комплексные соединения (большинство): K 3 , SO 4 , Na 2 и др.
Слабые электролиты (α < 0,3 или 30 %) диссоциируют на ионы незначительно и обратимо, к ним применим закон действующих масс. Их растворы состоят преимущественно из молекул. К слабым электролитам относятся многие неорганические и все органические кислоты, раствор аммиака, малорастворимые основания. Величина α слабых электролитов зависит от их концентрации: с разбавлением степень диссоциации увеличивается. Ее рассчитывают по закону разбавления Оствальда:
где К д – константа диссоциации слабого электролита (справочная величина);
C – молярная концентрация вещества, моль/л.
Расчеты точны только в разбавленных растворах при С < 0,1 моль/л. При больших концентрациях величину С заменяют активностью а :
a = f · С , (2)
где f – коэффициент активности (f < 1 – справочная величина).
Причина в том, что с увеличением концентрации в растворах начинает проявляться сильное ион – ионное взаимодействие: кулоновское взаимодействие катионов и анионов между собой. Например, в 0,1 М растворе fcndjhtраствореNaCl f = 0,78, а в 1 М растворе NaCl f = 0,66; в 0,001 М растворе CaCl 2 f = 0,84, а в 1 М растворе CaCl 2 f = 0,5.
Примеры диссоциации веществ без учета гидратации (в упрощенной форме)
Диссоциация кислот
Сильные кислоты сразу полностью диссоциируют на ионы
HClO 4 → H + + ClO 4 – (α ≈ 100 %).
Состав раствора: ионы H + и ClO 4 – .
Слабые кислоты диссоциируют на ионы обратимо
HClO ↔ H + + ClO – (α 0,1 М раствора = 0,05 %),
Состав раствора: молекулы HClO (> 99 %) и ионы H + , ClO – .
Слабые многоосновные кислоты диссоциируют на ионы обратимо и ступенчато
H 2 S ↔ H + + HS – (1 ступень диссоциации, α0,1 М раствора = 0,07 %),
HS – ↔ H + + S 2 – (2 ступень диссоциации, α << 1).
Состав раствора: молекулы H 2 S (> 99 %), немного ионов H + и HS – и крайне мало S 2 – .
Диссоциация оснований
Сильные основания сразу полностью диссоциируют на ионы
Ba(OH) 2 → Ba 2+ + 2OH – (α ≈ 100 %).
Состав раствора: ионы Ba 2+ и OH – .
Слабые основания диссоциируют на ионы обратимо (многокислотные основания диссоциируют ступенчато)
NH 4 OH ↔ NH 4 + + OH – (α0,1 М раствора = 1,3 %).
Состав раствора: преимущественно молекулы NH 4 OH и частично ионы NH 4 + и OH – .
Диссоциация солей
Средние соли сразу полностью диссоциируют на ионы:
Na 2 S → 2Na + + S 2 – (α ≈ 100 %).
Состав раствора: ионы Na + и S 2 - .
Кислые и основные соли диссоциируют на ионы по первой ступени как сильные электролиты – необратимо, а по второй и третьей ступеням как слабые электролиты – обратимо
NaHS → Na + + HS – (1 ступень диссоциации, α ≈ 100 %),
CuOНNO 3 → CuOH + + NO 3 – (1 ступень диссоциации, α ≈ 100 %).
Второй ступенью диссоциации можно пренебречь (α << 1).
| | | следующая лекция ==> | |
| Методика проведения эксперимента и обработка результатов | | |
Давно известно, что некоторые растворы проводят электрический ток (такие растворы получили название электролитов ), а некоторые - не проводят (неэлектролиты ).
Кроме электропроводности электролиты и неэлектролиты имеют много других отличий. При одинаковой молярной концентрации электролиты (по сравнению с неэлектролитами) обладают:
- более высокой температурой кипения;
- более низкой температурой замерзания;
- более высоким осмотическим давлением;
- более низким давлением пара растворителя.
Такое большое различие в свойствах растворов ученые объясняют тем фактом, что в электролитах при растворении образуется гораздо большее кол-во частиц, которые еще и обладают зарядом, хотя, в общем, раствор электролита нейтрален.
Впервые теорию электролитической диссоциации (разделения) сформулировал в 1887 г. шведский ученый С. Аррениус, ее основные положения заключались в следующем:
- электролиты, растворяясь в воде, диссоциируют (распадаются) на положительно (катионы) и отрицательно (анионы) заряженные ионы;
- под воздействием внешнего электрического поля катионы в растворе электролита начнут двигаться к катоду (отрицательному электроду), анионы - к аноду (положительному электроду);
- электролитическая диссоциация является обратимым процессом - параллельно с распадом молекул на ионы идет обратный процесс ассоциации (ионы соединяются в молекулы), в результате чего в растворе устанавливается динамическое равновесие.
Через несколько лет, в 1891 г., русский ученый И. Каблуков внес существенные уточнения в теорию Аррениуса, введя понятие сольватации катионов и анионов (формирование химических связей между растворителем и растворяемым веществом).
Ионами называют атомы (группы атомов), которые имеют заряд (положительный - анионы или отрицательный - катионы ).
Ионы бывают:
- простые - Na + , Mg 2+ , S 2- , Cl -
- сложные - NO 3 - , NH 4 + , SO 4 2- , PO 4 3-
Механизм электролитической диссоциации
Электролиты бывают двух видов: раствором с ионной связью и раствором с ковалентной связью.
Растворители, в которых протекает процесс диссоциации, обязательно состоят из полярных молекул.
Механизм диссоциации электролитов с ионной и ковалентной связью различен.
Хлорид натрия является веществом с ионной связью , в узлах кристаллической решетки NaCl находятся ионы натрия и хлора.
Рис. 1. Кристаллическая решетка хлорида натрия.
При погружении поваренной соли в воду на первой стадии растворения (диссоциации NaCl) полярные молекулы воды под действием электростатического притяжения приклеиваются своей отрицательной стороной к катионам натрия (Na +), а положительной стороной к анионам хлора (Cl -):

Рис. 2 Притяжение полярных молекул воды к ионам NaCl.
По мере склеивания молекул воды с ионами натрия и хлора происходит ослабление ионных связей Na + с Cl - :
Кристаллическая решетка постепенно разрушается, в результате чего, освободившиеся ионы переходят в раствор, в котором они тут же связываются с молекулами воды - такие ионы называются гидратированными .

Рис. 3 Ослабление ионных связей хлорида натрия.
Ионные связи хлорида натрия разрываются и гидратированные ионы переходят в раствор:

Рис. 4 Переход гидратированных ионов натрия и хлора в раствор.
В водном растворе диссоциация ионных соединений всегда протекает полностью .
Диссоциация хлороводорода
Хлороводород является веществом с ковалентной полярной связью .
Под воздействием молекул воды ковалентные связи поляризуются еще больше и становятся связями ионными, после чего происходит процесс, описанный выше:

Рис. 5 Диссоциация полярной молекулы HCl.
Из вышесказанного можно сделать вывод, что электролитическая диссоциация возможна в полярных растворителях (вода, этиловый спирт). При диссоциации в первую очередь разрываются наиболее полярные связи (самая большая разность в электроотрицательности атомов, составляющих связь; см. Понятие электроотрицательности).
Растворитель выполняет не только роль разделения катионов и анионов растворяемого вещества, но также замедляет обратный процесс ассоциации ионов в исходную молекулу, поскольку сольватированные (гидратированные) ионы окружены "прилипшими" молекулами растворителя, что мешает сближению (под воздействием кулоновского электростатического притяжения) и воссоединению в молекулу катионов и анионов. Кол-во молекул растворителя, находящихся в гидратной оболочке ионов, зависит от природы ионов, концентрации и температуры раствора.
Одно из главных отличий диссоциации электролитов с полярной связью от диссоциации электролитов с ионной связью заключается в том, что такая диссоциация может быть частичной - это зависит от полярности связей в молекулах электролитов.
Уравнения электролитических диссоциаций записываются следующим образом:
NaCl ↔ Na + + Cl - HCl ↔ H + + Cl -
Электролитическая диссоциация протекает за счет энергии, выделяемой в процессе разрушения кристаллической решетки растворяемого вещества во время взаимодейтсвия молекул растворителя с веществом. Следует сказать, что диссоциация может протекать и без растворителя, например, при высокой температуре, когда образуется расплав вещества (энергия для разрушения кристаллической решетки берется из внешнего источника высокой температуры).
ИТОГ : Электролитическая диссоциация - это процесс распада вещества (электролита) на ионы (в растворах под воздействием полярных молекул растворителя; в расплавах - под воздействием высокой температуры).
Свойства ионов
Атомы элементов и их ионы - это далеко не "родственники". По своим физическим и химическим свойствам ионы сильно отличаются от нейтральных атомов, из которых они образовались.
Например атомы натрия активно взаимодейтсвуют с водой, а анионы натрия не взаимодействуют с водой. Хлор в свободном состоянии является ядовитым газом желто-зеленого цвета, а хлорид-ионы не ядовиты, не имеют запаха и цвета.p>
Такие сильные различия между атомами и их ионами объясняются разным электронным строением.
При наличии в растворе нескольких электролитов они диссоциируют в сторону образования: 1) осадков; 2) газов; 3) слабых электролитов.
- пример диссоциации с образованием осадков: BaCl 2 +Na 2 SO 4 = BaSO 4 ↓+2NaCl Ba 2+ +2Cl - +2Na + +SO 4 2- =BaSO 4 ↓+2Na + +2Cl - 2Cl - и 2Na + можно сократить Сокращенное ионное уравнение: Ba 2+ +SO 4 2- =BaSO 4 ↓
- пример диссоциации с образованием газов: CaCO 3 +2HCl = CaCl 2 +CO 2 +H 2 O Сокращенное ионное уравнение: CaCO 3 +2H + =Ca 2+ +CO 2 +H 2 O
- пример диссоциации с образованием слабых электролитов: HCl+NaOH = NaCl+H 2 O Сокращенное ионное уравнение: H + +OH - = H 2 O
История открытия такого интересного явления в химии как электролитическая диссоциация началась в 1887 году, когда шведский химик Сванте Аренниус во время исследований электропроводности водных растворов, высказал предположение, что в подобных растворах вещества могут распадаться на заряженные частицы – ионы. Ионы эти пребывают в движении, передвигаясь к электродам, как положительно заряженному катоду, так и отрицательно заряженному аноду. Этот процесс распада и получил название электролитической диссоциации, именно он является причиной появления электрического тока в растворах.
Теория электролитической диссоциации
Классическая теория электролитической диссоциации, разработанная первооткрывателем С. Аренниусом совместно с В. Освальдом, прежде всего, предполагала, что распад молекул на ионы (собственно диссоциация) происходит под действием электрического тока. Впоследствии выяснилось, что это не совсем так, поскольку было выявлено существование ионов в водных растворах, независимо от того, проходил через них ток или нет. Тогда Сванте Аренниус сформировал новую теорию, суть ее заключается в том, что электролиты самопроизвольно распадаются на ионы под воздействием растворителя. А уже наличие ионов создают идеальные условия для электропроводности в растворе.

Примерно так выглядит электролитическая диссоциация схематично.
Большое значение электролитической диссоциации в растворах заключается в том, что она позволяет описывать свойства кислот, оснований и солей, и далее мы детально на этом остановимся
Электролитическая диссоциация кислот
Н 3 РО 4 ⇄ Н + Н 2 РО- 4 (первая ступень)
Н 2 РО 4 ⇄ Н + НРO 2 - 4 (вторая ступень)
Н 2 РО 4 ⇄ Н+ PО З - 4 (третья ступень)
Так выглядят химические уравнения электролитической диссоциации кислот. В примере показана электролитическая диссоциация фосфорной кислоты Н 3 РО 4 которая распадается на водород H (катион) и ионы анодов. Причем диссоциация много основных кислот проходит, как правило, только по первой ступени.
Электролитическая диссоциация оснований
Основания отличаются от кислот тем, что при их диссоциации в качестве катионов образуются гидроксид-ионы.
Пример уравнения химической диссоциации оснований
KOH ⇄ K + OH-; NH 4 OH ⇄ NH+ 4 + OH-
Основания, которые растворяются в воде, называют щелочами, их не так уж и много, в основном это основания щелочных и щелочноземельных , таких как LiOH, NaОН, КОН, RbОН, СsОН, FrОН и Са(ОН) 2 , Sr(ОН) 2 , Ва(ОН) 2 , Rа(ОН) 2
Электролитическая диссоциация солей
При электролитической диссоциации солей в качестве катионов образуются металлы, а также катион аммония NH 4 , а анионами стают кислотные остатки.
(NH 4) 2 SO 4 ⇄ 2NH+ 4 + SO 2 - 4 ; Na 3 PO 4 ⇄ 3Na + PO 3- 4
Пример уравнения электролитической диссоциации солей.
Электролитическая диссоциация, видео
И в завершение образовательное видео по теме нашей статьи.