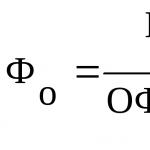В химии равновесное состояние характеризует большинство газообразных и жидких систем, а также большую группу твердых сплавов. Поэтому закономерности химического равновесия имеют важное практическое значение. При анализе уравнения для энергии Гиббса обнаруживается, что в термодинамических системах могут возникнуть состояния, когда одновременно протекают противоположно направленные процессы, но при этом состояние системы в целом остается равновесным, т.е. ее параметры неизменны (А= 0). Неизменность параметров системы во времени, однако, является необходимым, но не достаточным условием истинного химического равновесия. При определенных условиях достаточно долго могут быть неизменными и параметры систем, в которых возможны реакции типа
Например, неизменной во времени является смесь газообразного аммиака с воздухом. Однако достаточно внести в эту смесь нагретый катализатор - оксид хрома Сг 2 О э, как начинается реакция, приводящая к образованию диоксида азота М0 2:

Расчет по уравнению Гиббса - Гельмгольца показывает, что для этой реакции AG 2 ° 98 0 и она принадлежит к реакциям типа (11.1). Значит, в данном случае мы имели дело не с истинным равновесием в системе, а только с заторможенным (метастабилъным) состоянием.
Модельной реакцией, описывающей истинно равновесные системы, будет
Конкретным примером истинно равновесной гомогенной системы является водный раствор, приготовленный из двух солей: хлорида железа(Ш) FeCl 3 и роданида калия KCNS и содержащий четыре вещества. Кроме указанных реагентов в его составе и два продукта реакции - роданид железами) Fe(CNS) 3 и хлорид калия КСЛ:
Реакции этого типа носят название кинетически-обратгшых, поскольку они протекают как в прямом, так и в обратном направлениях при любых состояниях системы. В области параметров, когда скорости прямой и обратной реакций становятся равными, система становится и термодинамически обратимой. Поэтому часто говорят об обратимости таких реакций, не уточняя, какой тип обратимости имеется в виду. Изменение энергии Гиббса в системах, где протекают реакции типа (11.1) и (11.2), могут быть представлены диаграммой (рис. 11.2).

Рис. 11.2.
На оси абсцисс диаграммы приведен состав системы (изменяется от чистых реагентов А; В в начальном (нач) состоянии, до чистых продуктов реакции П; Р в конечном (кон) состоянии) в мольных долях X, каждого компонента, а на оси ординат - величина энергии Гиббса для смеси текущего состава. Как следует из диаграммы, для реакции типа (11.1) зависимость энергии Гиббса от состава монотонна. Величина С системы по мере протекания процесса уменьшается, а величина Д,С (индекс г подчеркивает, что это изменение энергии Гиббса для химической реакции), равная разности энергий Гиббса в начальном и конечном состояниях, всегда отрицательна.
Для реакции типа (11.2) картина иная. Величина С системы на этой диаграмме имеет минимум, и вся диаграмма разбивается на две области: слева от точки Z по мере протекания процесса величина ts.fi (изменение энергии Гиббса для прямой (пр) реакции) отрицательна, а справа от точки Z по мере протекания процесса отрицательна величина А г (? обр (изменение энергии Гиббса для обратной (обр) реакции). Точка Z является точкой равновесия - в ней и А г С пр, и А; .С оГ)р равны нулю. Состав системы в точке Z называется равновесным составом. Состояние равновесия в точке Z в химической термодинамике характеризуется особой величиной - константой равнове-
СиЯ Яравн-
Константа равновесия для состояния системы при постоянной температуре есть постоянная величина. Константа равновесия может быть выражена через различные параметры системы, что отражается индексами: К с (через молярные концентрации), К х (через мольные доли), К р (через парциальные давления) и др. Алгоритм построения выражения для константы равновесия прост: она равна дроби, в числителе которой произведение равновесных параметров (концентраций, парциальных давлений, мольных долей и др.) продуктов реакции в степенях, равных стехиометрическим коэффициентам соответствующих веществ, а в знаменателе - аналогичное произведение для реагентов.
Рассмотрим выражение
![]() для модельной реакции (11.2):
для модельной реакции (11.2):
Формула вещества, заключенная в квадратные скобки, означает молярную концентрацию вещества в системе. Когда из контекста ясно, что речь идет о состоянии равновесия, индекс «равн» опускается. Особенности формы записи констант равновесия в случае гетерогенных систем будут рассмотрены в этой главе позже. Если какой-то компонент в системе представляет собой твердое тело, то его концентрация есть величина постоянная, она переносится в левую часть и включается в константу равновесия. В этом случае в аналитическом выражении такой компонент не представлен.
Аналитически константы равновесия различных типов связаны друг с другом следующим образом:
При этом каким бы образом ни выражалась К равн, она является параметром системы и не зависит от положения точки Z. Эта точка является подвижной и зависит от способа приготовления системы, что можно проверить экспериментально. Если изменить соотношение компонентов в исходном состоянии, например добавить в систему компоненты О и Е (продукты реакции), то положение точки Z сместится влево, если же добавить компоненты А и В (реагенты), то вправо. Ниже рассмотрено такое смещение положения точки равновесия системы на основании принципа Ле Шателье - Брауна.
Константы равновесия могут быть как размерными, так и безразмерными величинами. Размерность константы равновесия определяется размерностью величины, через которую она выражена (концентрация, парциальное давление и др.), и равна этой размерности в степени, равной разнице между коэффициентами конечных и начальных компонентов реакции:
![]()
Константа равновесия записывается в виде дроби, в числитель которой входят параметры продуктов реакции, а в знаменатель - параметры начальных веществ. Наиболее удобно выражать константу равновесия через мольные доли (в таком случае она не имеет размерности):
![]()
Для процессов с участием газообразных компонентов удобно выражать константу равновесия через парциальные давления газообразных компонентов:
![]()
Выражение константы равновесия через молярные концентрации удобно для процессов при постоянном объеме или в растворах (если объем растворов практически остается постоянным):
![]()
Если процесс идет без изменения числа молей (Ду = 0), то все выражения констант равновесия совпадают:
![]()
В таком случае все константы равновесия становятся безразмерными.
В некоторых случаях надо знать не только направление окислительно-восстановительной реакции, но и насколько полно она протекает. Так, например, в количественном анализе можно опираться только на те реакции, которые практически протекают на 100% (или приближаются к этому).
Степень протекания реакции слева направо определяется константой равновесия. Для реакции
согласно закону действия масс, можно записать:
![]()
где К - константа равновесия, показывающая, каково соотношение между концентрациями ионов и при равновесии.
Константу равновесия определяют следующим образом. В уравнение (3) (стр. 152) подставляют значения нормальных потенциалов пар и и находят:

При равновесии = или


Константа равновесия показывает, что цинк вытесняет из ионы меди до тех пор, пока в растворе концентрация ионов не станет в раз меньше, чем концентрация ионов . Это значит, что рассматриваемая реакция практически идет до конца.
Если, например, концентрация в начале реакции равна 0,1 м, то при равновесии будет 0,1 - х в то время как концентрация будет х.
Решая уравнение концентрация при равновесии очень близка к 0,1 м.
Однако, если бы мы могли изменить соотношение взаимодействующих компонентов так, чтобы оно стало , т.е. или тогда реакция пошла бы справа налево (т. е. в обратном направлении).
Константа равновесия для любых окислительно-восстановительных процессов может быть вычислена, если известны окислительновосстановительные потенциалы частных реакций.
Константа равновесия связана с окислительно-восстановитель-ными потенциалами общей формулой:

где К - константа равновесия реакции; и нормальные потенциалы (окислителя и восстановителя); n - зарядность ионов (число электронов, отдаваемых восстановителем и принимаемых окислителем).
Из формулы (4) находим константу равновесия:

Зная константу равновесия, можно, не прибегая к опытным данным, рассчитать, насколько полно протекает реакция.
Так, например, в реакции
для пары =-0,126 в, для пары =-0,136 в.
Подставляя эти данные в уравнение (4), находим:
![]()
Число 2,21 означает, что равновесие в рассматриваемой реакции наступает тогда, когда концентрация ионов станет в 2,21 раза меньше концентрации ионов .
Концентрация ионов при равновесии в 2,21 раза больше концентрации ионов . Поэтому на 2,21 грамм-иона приходится 1 грамм-ион . Всего же в растворе содержится 3,21 грамм-иона (2,21+1). Таким образом, на 3,21 грамм-иона в растворе приходится 2,21 грамм-иона , а на 100 частей будет приходиться x частей .

Следовательно, данная реакция протекает обратимо. Вычислим константу равновесия для реакции:
Потенциал для пары =1,51 в, потенциал для пары =0,77 в. Подставив эти величины потенциалов в уравнение (4), находим:

Эта константа показывает, что равновесие наступает, когда произведение концентраций ионов в числителе (образующихся при реакции) станет в раза больше произведения концентраций ионов знаменателя (вступающих в реакцию).
Ясно, что данная реакция протекает практически необратимо (т. е. на 100% слева направо).
Для реакции
Расчет (аналогичный приведенному выше) показывает, что эта реакция протекает на .
Равновесие изменяется в зависимости от условий реакции.
Исключительное влияние на величину константы оказывает реакция среды. Так, например, реакция восстановления мышьяковой кислоты ионом иода в кислой среде протекает по уравнению:
Потенциал восстановления мышьяковой кислоты в щелочной среде значительно меньше. Поэтому в щелочной среде имеет место обратный процесс:
В нейтральной среде оба процесса можно было бы представить так:

однако так они не пойдут.
Процесс по первому уравнению не пойдет, потому что он связан с накоплением ионов , которые направляют процесс в обратную сторону; только при создании кислой среды, нейтрализующей гидроксид-ионы, он пойдет слева направо.
По второму уравнению процесс не пойдет, потому что он связан с накоплением ионов , которые следует нейтрализовать щелочью, если нужно, чтобы реакция шла слева направо.
Существует следующее правило для создания реакционной среды, необходимой для оптимального течения процесса:
Если в результате окислительно-восстановительной реакции накапливаются водородные или гидроксид-ионы, то для желаемого течения процесса необходимо создать такую среду, которая обладает противоположными свойствами: в случае накопления ионов среда должна быть щелочной, в случае же накопления ионов среда должна быть кислой.
Для реакции нужно брать такие компоненты, которые требуют одинаковой среды (кислой или щелочной). Если же в реакции одно вещество является восстановителем в кислой среде, а другое окислителем в щелочной, то может иметь место торможение процесса; в этом случае процесс дойдет до конца лишь при большой разнице потенциалов, т. е. при высокой константе реакции.
Константа равновесия позволяет предсказать возможность окисления, например, и азотной кислотой.
Найдем константу равновесия для реакции растворения в . хорошо растворяется в разбавленной . Константа равновесия для реакции:
может быть вычислена из уравнения:
Столь малая величина константы говорит о том, что равновесие этой реакции практически нацело сдвинуто справа налево, т. е. сульфид ртути в противоположность сульфиду меди практически не растворим в разбавленной .

Поскольку все химические реакции обратимы, для обратной реакции (по отношению к той, когда молекул А реагируют с молекулами В)
![]()
соответствующее выражение для скорости реакции будет иметь вид
Обратимость обозначается двойными стрелками:
Это выражение следует читать: молекул А и молекул В находятся в равновесии с Знак пропорциональности можно заменить на знак равенства, если ввести коэффициент пропорциональности к, характерный для рассматриваемой реакции. В общем случае
выражения для скорости прямой реакции (Скорость) и обратной реакции (Скорость ) принимают вид
![]()
Когда скорости прямой и обратной реакций равны, говорят, что система находится в равновесии:


Отношение называется константой равновесия Следует запомнить следующие свойства системы, находящейся в состоянии равновесия
1. Константа равновесия равна отношению констант скоростей прямой и обратной реакций,
2. В равновесии скорости прямой и обратной реакций (но не их константы) равны.
3. Равновесие является динамическим состоянием. Хотя суммарного изменения концентрации реагентов и продуктов в равновесии не происходит. А и В постоянно превращаются в и наоборот.
4. Если известны равновесные концентрации А, В и можно найти численное значение константы равновесия.
Связь между константой равновесия и изменением стандартной свободной энергии реакции
Константа равновесия связана с соотношением
Здесь - газовая постоянная, Т - абсолютная температура. Поскольку их значения известны, зная численное значение можно найти Если константа равновесия больше единицы, реакция идет самопроизвольно, т. е. в том направлении, как она написана (слева направо). Если же константа равновесия меньше единицы, то самопроизвольно идет обратная реакция. Заметим, однако, что константа равновесия указывает направление, в котором реакция может идти самопроизвольно, но не позволяет судить, будет ли реакция идти быстро. Иными словами, она ничего не говорит о высоте энергетического барьера реакции (; см. выше). Это следует из того, что определяет только А (7°. Скорости реакций зависят от высоты энергетического барьера, но не от величины
Константа химического равновесия - характеристика химической реакции, по значению которой можно судить о направлении процесса при исходном соотношении концентраций реагирующих веществ, о максимально возможном выходе продукта реакции при тех или иных условиях.
Константа химического равновесия определяется по закону действующих масс . Ее значения находят расчетно или на основании экспериментальных данных. Константа химического равновесия зависит от природы реагентов и от температуры.
Константа равновесия и энергия Гиббса
Константа равновесия ~K связана со свободной энергией Гиббса ~\Delta G следующим образом:
~\Delta G=-RT\cdot\ln K.Приведенное уравнение позволяет по величине ΔG° вычислить К, а затем и равновесные концентрации (парциальные давления) реагентов.
Из этого уравнения видно, что константа равновесия очень чувствительна к изменению температуры (если выразить отсюда константу, то температура будет в показателе степени). Для эндотермических процессов повышение температуры отвечает увеличению константы равновесия, для экзотермических - ее уменьшению. От давления константа равновесия не зависит, кроме случаев очень большого давления (от 100 Па).
Зависимость константы равновесия от энтальпийного и энтропийного факторов свидетельствует о влиянии на нее природы реагентов.
Константа равновесия и скорость реакции
Можно выразить константу равновесия через скорость реакции. При этом константа равновесия определяется как
~K=\frac{k_1}{k_{-1}},где ~k_1 - константа скорости прямой реакции, ~k_{-1} - константа скорости обратной реакции.