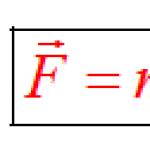Основната опора на химията, заедно с периодичната система на Д. И. Менделеев, структурата на органичните съединения на А. М. Бутлеров и други значими открития, е теорията на електролитната дисоциация. Разработен е от Сванте Арениус през 1887 г., за да обясни специфичното поведение на електролитите във вода и други полярни течности и стопилки. Той намира компромис между две категорично различни теории за съществуващите тогава разтвори - физична и химична. Първият твърди, че разтвореното вещество и разтворителят не взаимодействат помежду си по никакъв начин, образувайки проста механична смес. Второто е, че между тях има химическа връзка. Оказа се, че всъщност разтворите имат и двете свойства.
В следващите етапи от развитието на науката много учени продължиха изследванията и разработките в тази област, разчитайки на наличната информация за структурата на атомите и естеството на химичните връзки между тях. По-специално, I. A. Kablukov изучава въпроса за процесите на разтваряне, V. A. Kistyakovsky определя зависимостта на издигането на течен стълб в капиляр при условия на температура на кипене от молекулното тегло.
Съвременна интерпретация на теорията
Преди това откритие много свойства и обстоятелства на процесите на разделяне не са били изследвани, както и самите разтвори. Електролитната дисоциация е процесът на разлагане на вещество на съставните му йони във вода или други полярни течности, взаимодействие на частиците на съединението с молекулите на разтворителя и появата на подвижност на катиони и аниони във възлите на кристалната решетка поради топене. . В резултат на това образуваните вещества придобиват ново свойство - електропроводимост.
Йоните, намиращи се в свободно състояние на разтвор или стопилка, взаимодействат помежду си. Вероятно заредените отблъскват, противоположно заредените привличат. Заредените частици се солватират от молекули на разтворителя - всяка е плътно заобиколена от строго ориентирани диполи в съответствие със силите на привличане на Кулон; по-специално, те се хидратират, ако средата е водна. Катионите винаги имат по-големи радиуси от анионите поради специфичното разположение на частиците около тях със заряди, локализирани по краищата.
Състав, класификация и имена на заредени частици в светлината на електролитната дисоциация
Йонът е атом или група от атоми, които носят положителен или отрицателен заряд. Те се характеризират с конвенционално разделение на прости (K (+), Ca (2+), H (+) - състоящ се от един химичен елемент), сложни и сложни (OH (-), SO 4 (2-), HCO 3 (- ) - от няколко). Ако катион или анион е свързан с молекула на разтворителя, той се нарича солватиран, а с дипол на молекулата на Н2О - хидратиран.
При електролитна дисоциация на водата се образуват две заредени частици H (+) и OH (-). Водородният протон приема несподелена електронна двойка кислород от друга водна молекула в свободна орбитала, което води до образуването на хидрониев йон H 3 O (+).
Основните разпоредби на откритието на Арениус
Всички представители на класовете неорганични съединения, с изключение на оксидите, се разпадат в разтвори на ориентирани диполи на течности; в химичен план те се дисоциират в по-голяма или по-малка степен на съставните им йони. Този процес не изисква наличието на електрически ток; уравнението на електролитната дисоциация е неговото схематично обозначение.
Веднъж попаднали в разтвор или стопилка, йоните могат да бъдат изложени на електрически ток и да се движат насочено към катода (отрицателен електрод) и анода (положителен). Последните привличат противоположно заредени атомни агрегати. Това е мястото, където частиците са получили имената си - катиони и аниони.

Успоредно и едновременно с разлагането на веществото протича обратният процес - асоциирането на йони в първоначалните молекули, поради което не настъпва стопроцентово разтваряне на веществото. Това уравнение за реакцията на електролитна дисоциация съдържа знак за равенство между дясната и лявата му страна. Електролитната дисоциация, както всяка друга реакция, е подчинена на законите, управляващи химичното равновесие, и законът за действието на масите не е изключение. Той гласи, че скоростта на разлагане на йони е пропорционална на концентрацията на електролита.
Класификация на веществата по време на дисоциация
Химическата терминология разделя веществата на неразтворими, слабо разтворими и разтворими. Последните два са слаби и силни електролити. Информацията за разтворимостта на определени съединения е обобщена в таблицата за разтворимост. Дисоциацията на силни електролити е необратим процес, те напълно се разпадат на йони. Слаби - само частично, те се характеризират с феномена на асоцииране и следователно равновесието на протичащите процеси.

Важно е да се отбележи, че няма пряка връзка между разтворимостта и силата на електролита. При силните хора може да бъде слабо изразен. Точно като слабите електролити, те могат да бъдат силно разтворими във вода.
Примери за съединения, чиито разтвори провеждат електрически ток
Класът на "силните електролити" включва всички добре дисоцииращи киселини, като азотна, солна, бромна, сярна, перхлорна и други. В същата степен алкалите са алкални хидроксиди и отделни представители на групата на “алкалоземните метали”. Електролитната дисоциация на солите е интензивна, с изключение на някои цианати и тиоцианати, както и на живачен (II) хлорид.
Класът на "слабите електролити" е представен от други минерални и почти всички органични киселини: въглеродна, сулфидна, борна, азотиста, сярна, силициева, оцетна и др. Както и слабо разтворими и въглеводородни основи и амфотерни хидроксиди (хидроксиди на магнезий, берилий, желязо, цинк в степен на окисление (2+)). От своя страна, водните молекули са много слаби електролити, но все пак се разпадат на йони.
Количествено описание на дисоцииращите процеси
Степента на електролитна дисоциация всъщност характеризира мащаба на процеса на разделяне. Може да се изчисли - броят на частиците, разделени на йони, трябва да се раздели на общия брой молекули на разтвореното вещество в системата. Тази стойност се обозначава с буквата "алфа".

Логично е, че за силните електролити "α" е равно на единица или сто процента, тъй като броят на разпадналите се частици е равен на общия им брой. За слабите - винаги по-малко от един. Пълно разпадане на първоначалните молекули на йони във водна среда не се случва, а протича обратният процес.
Основните фактори, влияещи върху пълнотата на гниене
Степента на електролитна дисоциация се влияе от редица неоспорими фактори. На първо място е важно естеството на разтворителя и веществото, което се разпада в него. Например, всички силни електролити имат ковалентен, силно полярен или йонен тип връзка между техните съставни частици. Течностите са представени от диполи, по-специално вода, в молекулите има разделяне на зарядите и в резултат на тяхната специфична ориентация възниква електролитна дисоциация на разтвореното вещество.
Алфа стойността се влияе обратно от концентрацията. С увеличаването му стойността на степента на дисоциация намалява и обратно. Самият процес е изцяло ендотермичен, т.е. необходимо е определено количество топлина, за да започне. Влиянието на температурния фактор е оправдано, както следва: колкото по-висок е, толкова по-голяма е степента на дисоциация.
Второстепенни фактори
Многоосновните киселини, като фосфорната киселина и основите, съдържащи няколко хидроксилни групи, например Fe (OH) 3, се разлагат на йони на етапи. Установена е зависимост - всеки следващ етап на дисоциация се характеризира със степен, която е хиляди или десетки хиляди пъти по-малка от предходния.

Степента на разлагане може да се промени и чрез добавяне на други електролити към системата, променяйки концентрацията на един от йоните на основното разтворено вещество. Това води до изместване на равновесието встрани, което се определя от правилото на Le Chatelier-Brown - реакцията протича в посоката, в която се наблюдава неутрализиране на влиянието, оказвано върху системата отвън.
Класическа константа на процеса на равновесие
За характеризиране на процеса на разлагане на слаб електролит, в допълнение към неговата степен, се използва константата на електролитна дисоциация (K d), която се изразява чрез съотношението на концентрациите на катиони и аниони към количественото съдържание на оригиналните молекули в системата. По същество това е обичайната химическа равновесна константа за обратимата реакция на разделяне на разтворено вещество на йони.
Например, за процеса на разлагане на съединение на съставните му частици, константата на дисоциация (K d) ще се определя от частното на постоянните концентрации на катиони и аниони в разтвора, повишени до степени, съответстващи на числата пред тях в химическото уравнение и общия брой на останалите недисоциирани формулни единици разтворено вещество. Има зависимост - колкото по-висока е (K d), толкова по-голям е броят на катионите и анионите в системата.
Връзката между концентрацията на слабо разлагащо се съединение, степента на дисоциация и константата се определя с помощта на закона за разреждане на Оствалд по уравнението: K d = α 2 s.
Водата като слабо дисоцииращо вещество
Диполните молекули се разпадат в изключително малка степен на заредени частици, тъй като това е енергийно неизгодно. Все пак се получава разделяне на водородни катиони и хидроксилни аниони. Като се вземат предвид процесите на хидратация, можем да говорим за образуването на хидрониеви и ОН (-) йони от две водни молекули.

Постоянната дисоциация се определя от съотношението на продукта на водородните протони и хидроксидните групи, наречен йонен продукт на вода, към равновесната концентрация на недисоциирани молекули в разтвора.
Електролитната дисоциация на водата определя наличието на Н (+) в системата, които характеризират нейната киселинност, и наличието на ОН (-) - основност. Ако концентрациите на протонната и хидроксилната група са равни, такава среда се нарича неутрална. Има така наречения водороден индекс - това е отрицателен логаритъм от общото количествено съдържание на Н (+) в разтвора. pH по-малко от 7 показва, че средата е киселинна, повече показва, че е алкална. Това е много важна стойност; биологичните, биохимичните и химичните реакции на различни водни системи - езера, езера, реки и морета - се анализират въз основа на нейната експериментална стойност. Значението на водородния индекс за промишлените процеси също е неоспоримо.
Записване на реакции и нотиране
Уравнението на електролитната дисоциация с помощта на химични символи описва процесите на разлагане на молекулите в съответните частици и се нарича йонно. Той е в пъти по-опростен от стандартния молекулярен и има по-общ вид.

При изготвянето на такова уравнение трябва да се има предвид, че веществата, които се утаяват или се отстраняват от реакционната смес като част от газовите пари по време на реакцията, трябва винаги да се записват само в молекулна форма, за разлика от електролитните съединения, силни представители на които влизат в състава само под формата на разделени на йони разтвори. Електролитната дисоциация за тях е необратим процес, тъй като свързването е невъзможно поради образуването на неделящи се вещества или газове. За този тип уравнения важат същите правила, както за другите химични реакции - сумите на коефициентите на лявата и дясната страна трябва да са равни една на друга, за да се поддържа материален баланс.
Електролитната дисоциация на киселини и основи може да се извърши на няколко етапа, ако веществата са многоосновни или поликиселинни. За всяка подреакция е написано собствено уравнение.
Роля в химическата наука и нейното развитие
Създаването на теорията на Сванте Арениус е от голямо значение за общия процес на формиране на физическата и в частност на електрохимичната наука. Въз основа на откриването на такова явление като електролитна дисоциация, електродните процеси, спецификата на преминаване на токове през различни среди и теорията за индуциране на катодно-анодни потенциали получиха интензивно развитие. Освен това теорията на разтворите е напреднала значително. Безпрецедентни открития очакваха химическата кинетика, областта на корозията на метали и сплави, както и работата по намирането на нови средства за защита срещу нея.
Все още има толкова много ново и непознато в съвременния свят. Всеки ден учените напредват в знанията си за такава велика дисциплина като химията. Електролитната дисоциация, както и нейните създатели и последователи, завинаги са заемали почетно място в контекста на развитието на световната наука.
Разпадането на електролитните молекули на йони под въздействието на молекули на полярния разтворител се нарича електролитен дисоциация. Веществата, чиито водни разтвори или стопилки провеждат електрически ток, се наричат електролити.
Те включват вода, киселини, основи и соли. Когато се разтворят във вода, електролитните молекули се дисоциират на положителни йони - катионии отрицателен - аниони. Процесът на електролитна дисоциация се причинява от взаимодействието на вещества с вода или друг разтворител, което води до образуването на хидратирани йони.
Така водороден йон образува хидрониев йон:
H+ + H2O «H3O+.
За да се опрости, хидрониевият йон се изписва без да се посочват водните молекули, тоест H+.
NaCl + nH2O ® Na+(H2O)x + Cl–(H2O)n-x,
или записът се приема: NaCl « Na+ + Cl–.
Дисоциация на киселини, основи, соли
Киселинисе наричат електролити, при дисоциацията на които като катиони се образуват само водородни катиони. Например,
HNO3 « H+ + NO3–
Многоосновните киселини се дисоциират стъпаловидно. Например сероводородната киселина се дисоциира стъпаловидно:
H2S « H+ + HS– (първи етап)
HS– « H+ + S2– (втори етап)
Дисоциацията на многоосновните киселини се извършва главно в първия етап. Това се обяснява с факта, че енергията, която трябва да се изразходва за отделяне на йон от неутрална молекула, е минимална и става по-голяма с дисоциацията при всяка следваща стъпка.
Причинисе наричат електролити, които се дисоциират в разтвор и образуват само хидроксидни йони като аниони. Например,
NaOH ® Na+ + OH–
Поликиселинните основи се дисоциират стъпаловидно
Mg(OH)2 « MgOH+ + OH– (първи етап)
MgOH+ « Mg2+ + OH– (втори етап)
Постепенната дисоциация на киселини и основи обяснява образуването на киселинни и основни соли.
Има електролити, които се дисоциират като основни и киселинни. Те се наричат амфотерни.
H+ + RO– « ROH « R+ + OH–
Амфотерността се обяснява с малката разлика в силата на връзките R–H и O–H.
Амфотерните електролити включват вода, хидроксиди на цинк, алуминий, хром (III), калай (II, IV), олово (II, IV) и др.
Дисоциацията на амфотерен хидроксид, например Sn(OH)2, може да се изрази с уравнението:
2H+ + SnO22– « Sn(OH)2 « Sn2+ + 2OH–
2H2O ¯ основни свойства
2H+ + 2–
киселинни свойства
солисе наричат електролити, които при дисоциация образуват метални катиони или комплексни катиони и аниони на киселинни остатъци или комплексни аниони.
Средните соли, разтворими във вода, се дисоциират почти напълно
Al2(SO4)3 « 2Al3+ + 2SO42–
(NH4)2CO3 « 2NH4+ + CO32–
Киселинните соли се дисоциират поетапно, например:
NaHCO3 « Na+ + HCO3– (първи етап)
Анионите на киселинните соли впоследствие леко се дисоциират:
HCO3– « H+ + CO32– (втори етап)
Дисоциацията на основна сол може да се изрази с уравнението
CuOHCl « CuOH+ + Cl– (първи етап)
CuOH+ « Cu+2 + OH– (втори етап)
Катионите на основните соли се дисоциират във втория етап в незначителна степен.
Двойните соли са електролити, които при дисоциация образуват два вида метални катиони. Например
KAl(SO4)2 « K+ + Al3+ + 2SO42–.
Комплексните соли са електролити, дисоциацията на които произвежда два вида йони: прости и сложни. Например:
Na2 « 2Na+ + 2–
Количествена характеристика на електролитната дисоциация е степен на дисоциацияа, равен на съотношението на броя молекули, разпаднати на йони (n) към общия брой разтворени молекули (N)
Степента на дисоциация се изразява в части от единица или процент.
Според степента на дисоциация всички електролити се разделят на силни (a>30%), слаби (a<3%) и средней силы (a - 3-30%).
Силни електролитиПри разтваряне във вода те напълно се дисоциират на йони. Те включват:
|
HCl, HBr, HJ, HNO3, H2SO4, HClO3, HClO4, HMnO4, H2SeO4 |
|
|
Причини |
NaOH, KOH, LiOH, RbOH, CsOH, Ba(OH)2, Ca(OH)2, Sr(OH)2 |
|
разтворим във вода (Приложение, Таблица 2) |
ЛАБОРАТОРИЯ 3
ЕЛЕКТРОЛИТИ
Цел на работата: изследване на химичните свойства на силни и слаби електролити.
Цели на работата: установете изместването на йонното равновесие в разтвори на слаби електролити; научете се да съставяте йонно-молекулни обменни реакции в електролитни разтвори.
Реактиви: CH 3 COONa (разтвор.), NaCl (разтвор.), разтвори: HCl (0,1 M), CH 3 COOH (0,1 M), H 2 SO 4, Pb(NO 3) 2, K 2 CrO 4, BaCl 2 , Na2SO4, CuSO4, NiSO4, Na2CO3, NH4Cl, NaOH (конц.), метилоранж; допълнително: NH4OH (разреден), NH4OH (конц.).
Оборудване:епруветки, пипети.
ТЕОРЕТИЧНА ЧАСТ
Неорганичните вещества, чиито разтвори провеждат електрически ток, се наричат електролити. Разтворите на много органични вещества (захари, алкохоли) не провеждат електричество и не са електролити.
Терминът „електролити“ е въведен от Фарадей, който смята, че проводимостта на разтворите се дължи на разлагането на веществата в електрическо поле (в превод от гръцки електролит означава „разложен от електричество“). Въпреки това в края на 19в. S. A. Arrhenius въз основа на свойствата на разтворите ∆T зам, ∆T кип, П Osm (законите на Raoult и van't Hoff) показаха, че разпадането се случва извън полето - на етапа на разтваряне на веществата. Арениус е автор на основите на теорията за електролитната дисоциация.
Съвременната теория на разтворите (I.A. Каблуков и D.I. Менделеев участват в нейното развитие) се основава на решаващата роля на разтворителя (полярни водни молекули) при дисоциацията. Процесът на поява на хидратирани йони във водни разтвори се нарича електролитна дисоциация.
Електролити– това са вещества, които се дисоциират (разпадат) на йони. Йоните в разтворите не са свободни, а образуват слаби съединения с водата – хидрати. Електролитите включват киселини, основи, соли и сложни съединения.
За да обясни разликите в свойствата (електрическа проводимост и други) между електролитите и неелектролитите, Арениус въвежда понятията за степента на дисоциация и силата на електролитите. Степен на електролитна дисоциация αе фракцията от молекули, които се разпадат на йони. Въз основа на степента на дисоциация електролитите се разделят на силни и слаби (понякога се изолират електролити със средна сила).
Силни електролити(α ≈ 1 или 100%) в разтвори почти напълно се дисоциират на йони. Разтворите се състоят само от йони (по-точно хидрати на йони). Този процес е необратим. Силните електролити включват:
Киселини: HCl, HBr, HI, HNO 3, HClO 3, HClO 4, H 2 Cr 2 O 7, HMnO 4, H 2 SO 4;
Основи (алкали): LiOH, NaOH, KOH, Ca(OH) 2, Ba(OH) 2, Sr(OH) 2;
Соли: почти всичко;
Комплексни съединения (повечето): K 3, SO 4, Na 2 и др.
слабелектролити (α< 0,3 или 30 %) диссоциируют на ионы незначительно и обратимо, к ним применим закон действующих масс. Их растворы состоят преимущественно из молекул. К слабым электролитам относятся многие неорганические и все органические кислоты, раствор аммиака, малорастворимые основания. Величина α слабых электролитов зависит от их концентрации: с разбавлением степень диссоциации увеличивается. Ее рассчитывают по закону разбавления Оствальда:
Където ДА СЕ d – константа на дисоциация на слаб електролит (референтна стойност);
° С– моларна концентрация на веществото, mol/l.
Изчисленията са точни само в разредени разтвори при СЪС < 0,1 моль/л. При больших концентрациях величину СЪСзаменен от дейност А:
a = f C, (2)
Където f– коефициент на активност ( f < 1 – справочная величина).
Причината е, че с увеличаване на концентрацията в разтворите започва да се появява силно йон-йонно взаимодействие: кулоновото взаимодействие на катиони и аниони един с друг. Например, в 0,1 М разтвор на fcndjht разтвор на NaCl f= 0,78 и в 1 М разтвор на NaCl f= 0,66; в 0,001 М разтвор на CaCl2 f= 0,84 и в 1 М разтвор на CaCl2 f = 0,5.
Примери за дисоциация на вещества без отчитане на хидратацията (в опростена форма)
Дисоциация на киселини
Силните киселини незабавно напълно се дисоциират на йони
HClO 4 → H + + ClO 4 – (α ≈ 100%).
Състав на разтвора: H + и ClO 4 – йони.
Слабите киселини се дисоциират на йони обратимо
HClO ↔ H + + ClO – ( α 0,1 М разтвор = 0,05%),
Състав на разтвора: HClO молекули (> 99%) и H +, ClO – йони.
Слабите многоосновни киселини се дисоциират на йони обратимо и стъпаловидно
H 2 S ↔ H + + HS – (1-ви етап на дисоциация, α0,1 М разтвор = 0,07%),
HS – ↔ H + + S 2 – (2-ри етап на дисоциация, α<< 1).
Състав на разтвора: H 2 S молекули (> 99%), малко H + и HS – йони и много малко S 2 – .
Основна дисоциация
Силните основи незабавно напълно се дисоциират на йони
Ba(OH) 2 → Ba 2+ + 2OH – (α ≈ 100%).
Състав на разтвора: Ba 2+ и OH – йони.
Слабите бази се дисоциират на йони обратимо (поликиселинните бази се дисоциират стъпаловидно)
NH 4 OH ↔ NH 4 + + OH – (α0,1 М разтвор = 1,3%).
Състав на разтвора: предимно NH 4 OH молекули и частично NH 4 + и OH – йони.
Дисоциация на соли
Средните соли веднага напълно се дисоциират на йони:
Na 2 S → 2Na + + S 2 – ( α ≈ 100 %).
Състав на разтвора: Na + и S 2 - йони.
Киселинните и основните соли се дисоциират на йони в първия етап като силни електролити - необратимо, а във втория и третия етап като слаби електролити - обратимо
NaHS → Na + + HS – (1ва стъпка на дисоциация, α ≈ 100 %),
CuONНNO 3 → CuOH + + NO 3 – (1-ви етап на дисоциация, α ≈ 100 %).
Вторият етап на дисоциация може да бъде пренебрегнат ( α << 1).
| | | следваща лекция ==> | |
| Експериментална процедура и обработка на резултатите | | |
Отдавна е известно, че някои разтвори провеждат електрически ток (такива разтвори се наричат електролити), а някои не ( неелектролити).
В допълнение към електрическата проводимост, електролитите и неелектролитите имат много други разлики. При същата моларна концентрация електролитите (в сравнение с неелектролитите) имат:
- по-висока точка на кипене;
- по-ниска температура на замръзване;
- по-високо осмотично налягане;
- по-ниско налягане на парите на разтворителя.
Учените обясняват такава голяма разлика в свойствата на разтворите с факта, че в електролитите при разтваряне се образуват много по-голям брой частици, които също имат заряд, въпреки че като цяло електролитният разтвор е неутрален.
За първи път теорията електролитна дисоциация(разделяне) е формулирано през 1887 г. от шведския учен С. Арениус, основните му разпоредби са както следва:
- електролитите, разтваряйки се във вода, се дисоциират (разпадат) на положително (катиони) и отрицателно (аниони) заредени йони;
- под въздействието на външно електрическо поле катионите в електролитния разтвор ще започнат да се движат към катода (отрицателен електрод), анионите - към анода (положителен електрод);
- електролитната дисоциация е обратим процес - успоредно с разпадането на молекулите на йони протича и обратен процес на асоцииране (йоните се обединяват в молекули), в резултат на което в разтвора се установява динамично равновесие.
Няколко години по-късно, през 1891 г., руският учен И. Каблуков прави значителни уточнения на теорията на Арениус, въвеждайки понятието хидратациякатиони и аниони (образуване на химични връзки между разтворителя и разтвореното вещество).
йонинаречени атоми (групи от атоми), които имат заряд (положителен - аниониили отрицателен - катиони).
Йоните са:
- прости - Na +, Mg 2+, S 2-, Cl -
- комплекс - NO 3 -, NH 4 +, SO 4 2-, PO 4 3-
Механизъм на електролитна дисоциация
Електролитите се предлагат в два вида: разтвор с йонна връзка и разтвор с ковалентна връзка.
Разтворителите, в които протича процесът на дисоциация, задължително се състоят от полярни молекули.
Механизмът на дисоциация на електролитите с йонни и ковалентни връзки е различен.
Натриевият хлорид е вещество с йонна връзка; натриевите и хлорните йони са разположени във възлите на кристалната решетка на NaCl.
Ориз. 1. Кристална решетка на натриев хлорид.
Когато готварската сол се потопи във вода в първия етап на разтваряне (дисоциация на NaCl), полярните водни молекули под въздействието на електростатично привличане се прилепват с отрицателната си страна към натриевите катиони (Na +), а с положителната към хлора аниони (Cl-):

Ориз. 2 Привличане на полярни водни молекули към NaCl йони.
Тъй като водните молекули се слепват заедно с натриеви и хлорни йони, йонните връзки между Na + и Cl - отслабват:
Кристалната решетка постепенно се разпада, в резултат на което освободените йони преминават в разтвор, в който веднага се свързват с водни молекули - такива йони се наричат хидратиран.

Ориз. 3 Отслабване на йонните връзки на натриев хлорид.
Йонните връзки на натриевия хлорид се разкъсват и хидратираните йони преминават в разтвор:

Ориз. 4 Преход на хидратирани натриеви и хлорни йони в разтвор.
Във воден разтвор дисоциацията на йонните съединения е винаги изтича напълно.
Дисоциация на хлороводород
Хлороводородът е вещество с полярна ковалентна връзка.
Под въздействието на водните молекули ковалентните връзки се поляризират още повече и се превръщат в йонни връзки, след което настъпва описаният по-горе процес:

Ориз. 5 Дисоциация на полярна HCl молекула.
От горното можем да заключим, че електролитната дисоциация е възможна в полярни разтворители (вода, етилов алкохол). По време на дисоциацията най-полярните връзки (най-голямата разлика в електроотрицателността на атомите, съставляващи връзката; вижте концепцията за електроотрицателност) се разкъсват първи.
Разтворителят не само изпълнява ролята на разделяне на катиони и аниони на разтвореното вещество, но също така забавя обратния процес на асоцииране на йони в оригиналната молекула, тъй като солватираните (хидратирани) йони са заобиколени от „залепващи“ молекули на разтворителя, което предотвратява подхода (под въздействието на кулоновото електростатично привличане) и обединяване в молекула на катиони и аниони. Броят на молекулите на разтворителя, присъстващи в хидратната обвивка на йони, зависи от природата на йоните, концентрацията и температурата на разтвора.
Една от основните разлики между дисоциацията на електролити с полярна връзка и дисоциацията на електролити с йонна връзка е, че такава дисоциация може да бъде частична - това зависи от полярността на връзките в електролитните молекули.
Уравненията на електролитната дисоциация се записват, както следва:
NaCl ↔ Na + + Cl - HCl ↔ H + + Cl -
Електролитната дисоциация възниква поради енергията, освободена по време на разрушаването на кристалната решетка на разтвореното вещество по време на взаимодействието на молекулите на разтворителя с веществото. Трябва да се каже, че дисоциацията може да възникне без разтворител, например при висока температура, когато се образува стопилка на веществото (енергията за разрушаване на кристалната решетка се взема от външен източник на висока температура).
РЕЗУЛТАТ: Електролитната дисоциация е процес на разлагане на вещество (електролит) на йони(в разтвори под въздействието на молекули на полярния разтворител; в стопилки - под въздействието на висока температура).
Свойства на йоните
Атомите на елементите и техните йони далеч не са „роднини“. По своите физични и химични свойства йоните са много различни от неутралните атоми, от които са образувани.
Например натриевите атоми активно взаимодействат с водата, но натриевите аниони не взаимодействат с водата. Хлорът в свободно състояние е отровен газ с жълто-зелен цвят, а хлоридните йони са нетоксични, без мирис и цвят.p>
Такива силни разлики между атомите и техните йони се обясняват с различни електронни структури.
Ако в разтвора има няколко електролита, те се дисоциират до образуването на: 1) утаяване; 2) газове; 3) слаби електролити.
- пример за дисоциация с образуване на утаяване: BaCl 2 +Na 2 SO 4 = BaSO 4 ↓+2NaCl Ba 2+ +2Cl - +2Na + +SO 4 2- =BaSO 4 ↓+2Na + +2Cl - 2Cl - и 2Na + може да се редуцира Съкратено йонно уравнение: Ba 2+ +SO 4 2- =BaSO 4 ↓
- пример за дисоциация за образуване на газове: CaCO 3 +2HCl = CaCl 2 +CO 2 +H 2 O Редуцирано йонно уравнение: CaCO 3 +2H + =Ca 2+ +CO 2 +H 2 O
- пример за дисоциация за образуване на слаби електролити: HCl+NaOH = NaCl+H 2 O Съкратено йонно уравнение: H + +OH - = H 2 O
Историята на откриването на такова интересно явление в химията като електролитна дисоциация започва през 1887 г., когато шведският химик Сванте Арениус, докато изучава електрическата проводимост на водни разтвори, предполага, че в такива разтвори веществата могат да се разпадат на заредени частици - йони. Тези йони са в движение, движейки се към електродите, както положително заредения катод, така и отрицателно заредения анод. Този процес на разлагане се нарича електролитна дисоциация, той е причината за появата на електрически ток в разтворите.
Теория на електролитната дисоциация
Класическата теория на електролитната дисоциация, разработена от откривателя S. Ahrennius заедно с W. Oswald, на първо място приема, че разпадането на молекулите на йони (самата дисоциация) се извършва под въздействието на електрически ток. Впоследствие се оказа, че това не е съвсем вярно, тъй като беше разкрито съществуването на йони във водни разтвори, независимо дали през тях преминава ток или не. Тогава Сванте Арениус формира нова теория, същността й е, че електролитите спонтанно се разпадат на йони под въздействието на разтворител. А наличието на йони създава идеални условия за електропроводимост в разтвора.

Така приблизително изглежда схематично електролитната дисоциация.
Голямото значение на електролитната дисоциация в разтворите се крие във факта, че ни позволява да опишем свойствата на киселини, основи и соли и по-нататък ще се спрем на това подробно
Електролитна дисоциация на киселини
N 3 PO 4 ⇄ N + N 2 PO- 4 (първи етап)
N 2 PO 4 ⇄ N + NPO 2 - 4 (втори етап)
N 2 PO 4 ⇄ N+ PO Z - 4 (трети етап)
Ето как изглеждат химичните уравнения за електролитна дисоциация на киселини. Примерът показва електролитната дисоциация на фосфорна киселина H 3 PO 4, която се разлага на водород H (катион) и анодни йони. Освен това, дисоциацията на много основни киселини се случва, като правило, само в първия етап.
Електролитна дисоциация на бази
Основите се различават от киселините по това, че когато се дисоциират, хидроксидните йони се образуват като катиони.
Пример за уравнение на основна химична дисоциация
KOH ⇄ K + OH-; NH 4 OH ⇄ NH+ 4 + OH-
Основите, които се разтварят във вода, се наричат алкали, няма толкова много от тях, главно алкални и алкалоземни основи, като LiOH, NaOH, KOH, RbOH, CsOH, FrOH и Ca(OH) 2, Sr(OH) 2, Ba(OH)2, Ra(OH)2
Електролитна дисоциация на соли
По време на електролитната дисоциация на солите се образуват метали като катиони, както и амониевият катион NH 4, а киселинните остатъци стават аниони.
(NH 4) 2 SO 4 ⇄ 2NH+ 4 + SO 2 - 4; Na 3 PO 4 ⇄ 3Na + PO 3-4
Пример за уравнение за електролитна дисоциация на соли.
Електролитна дисоциация, видео
И накрая, образователно видео по темата на нашата статия.