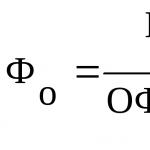Теоретичен материал за OGE задачи по химия
1.Структурата на атома. Структурата на електронните обвивки на атомите на първите 20 елемента от периодичната таблица D.I. Менделеев
Атомният номер на елемент е числено равен на заряда на ядрото на неговия атом, броя на протоните в ядротони общия брой електрони в атома.
Броят на електроните в последния (външен) слой се определя от номера на групата на химичния елемент.
Броят на електронните слоеве в атома е равен на номера на периода.
Масово число на атомА(равна на относителната атомна маса, закръглена до най-близкото цяло число) е общият брой протони и неутрони.
Брой неутронинопределя се от разликата между масовото число А и броя на протонитеЗ.
Изотопите са атоми на един и същи химичен елемент, които имат еднакъв брой протони в ядрото, но различен брой неутрони, т.е. същия ядрен заряд, но различна атомна маса.
2.
Периодичен закон и периодична система на химичните елементи D.I. Менделеев
По период(от ляво на дясно → )
По група
(отгоре надолу↓)
Основен заряд
Брой електронни слоеве
Брой валентни електрони
Повишаване на
Не се променя
Повишаване на
Повишаване на
Повишаване на
Не се променя
Атомни радиуси
Метални свойства
Възстановяващи свойства
Основни свойства на оксидите и хидроксидите
Намалява
Увеличават се
Електроотрицателност
Неметални свойства
Окислителни свойства
Киселинни свойства на оксидите и хидроксидите
Увеличават се
Намалява
3.
Структурата на молекулите.
Химическа връзка:
ковалентни (полярни и неполярни), йонни, метални
Ковалентен неполярен се образува връзка между еднакви неметални атоми (т.е. с еднаква стойност на електроотрицателност).
Ковалентен полярен се образува връзка между атоми на различни неметали (с различни стойности на електроотрицателност).
Йонна връзка се образува между атомите на типичните метали и неметали и в амониеви соли! (Н.Х. 4 кл, Н.Х. 4 НЕ 3 и т.н.)
Метална връзка - в метали и сплави.
Дължина на връзкатадефиниран:
радиуса на атомите на елементите: колкото по-големи са радиусите на атомите, толкова по-голяма е дължината на връзката;
множество връзки (единичната е по-дълга от двойната)
4.
Валентност на химичните елементи. Степен на окисление на химичните елементи
Степен на окисление – условният заряд на атом в молекула, изчислен въз основа на предположението, че всички връзки в молекулата са йонни.
Окислител приема електрони и възниква процес на редукция.
Редуциращ агент отдава електрони и протича процесът на окисление.
Валентност назовете броя на химичните връзки, които един атом образува в химично съединение. Често стойността на валентността съвпада числено със стойността на степента на окисление.
Разлики в степента на окисление и стойностите на валентностСтепен на окисление
Валентност
Прости вещества
О 0 2 з 0 2 н 0 2 Е 0 2 кл 0 2 бр 0 2 аз 0 2
О II 2 з аз 2 н III 2 Е аз 2 кл аз 2 бр аз 2 аз аз 2
Азотни съединения
HN +5 О 3
н 2 +5 О 5
н -3 з 4 кл
HN IV О 3
н 2 IV О 5
н IV з 4 кл(в амониев йон)
5.
Прости и сложни вещества. Основни класове
неорганични вещества. Номенклатура на неорганичните съединения
Сложни вещества – вещества, които съдържат атоми на различни химични елементи.
Киселини- сложни вещества, които обикновено съдържат атоми водород, който може да бъде заменен сметални атоми и киселинен остатък: НС1, з 3 Р О 4
Основания – сложни вещества, съдържащи метални йони и OH хидроксидни йони - : NaOH, ок(ОХ) 2
соли средно сложни вещества, състоящи се от метални катиони и аниони на киселинни остатъци (CaCO 3 ) . Киселинните соли също съдържат водороден атом(и) ( ок( HCO 3 ) 2 ) . Основните соли съдържат хидроксидни йони ((CuOH) 2 CO 3 ) .
Оксиди – сложни вещества, които съдържат атоми на два елемента, единият от които задължително е кислород в степен на окисление (-2). Оксидите се класифицират като основни, киселинни, амфотерни и необразуващи соли.
метали със степен на окисление +3, +4 иZn +2 , Бъда +2
неметали
метали със степен на окисление +5, +6, +7
Оксиди CO, НЕ, н 2 О– не са солеобразуващи.
6.
Химическа реакция. Условия и признаци на химичните реакции. Химични уравнения. Запазване на масата на веществата по време на химични реакции. Класификация на химичните реакции според различни критерии: броя и състава на изходните и получените вещества, промените в степента на окисление на химичните елементи, абсорбцията и освобождаването на енергия
Химична реакция - явления, при които от едно вещество се образуват други вещества.
Признаци на химическа реакция са отделянето на светлина и топлина, образуването на утайка, газ, появата на миризма и промяна на цвета.
Запазване на масата на веществата по време на химични реакции.
Сумата от коефициентите в уравнението на реакцията:Fe +2 НС1 → FeCl 2 (1+2+1=4)
Класификация на химичните реакции
Според броя и състава на изходните и получените вещества се разграничават реакциите:
Връзки A+B = AB
Разширение AB = A+ B
Замени A + BC = AC + B
Размяна AB + C д = AD + C.B.
Обменните реакции между киселини и основи са реакции на неутрализация.
Чрез промяна на степента на окисление на химичните елементи:
Окислително-редукционни реакции (ORR), по време на които се променят степените на окисление на химичните елементи.
Ако обикновено вещество участва в реакция, това винаги е ORR
Реакциите на заместване винаги са ORR.
Нередокс реакции, по време на които няма промяна в степента на окисление на химичните елементи. !Реакциите на обмен винаги не са OVR.
Чрез абсорбция и освобождаване на енергия:
възникват екзотермични реакции с отделяне на топлина (това са всички реакции на изгаряне, обмен, заместване, повечето съединения);
ендотермичните реакции протичат с абсорбцията на топлина (реакции на разлагане)
По посока на процеса : обратими и необратими.
Според наличието на катализатор : каталитични и некаталитични.
7.
Електролити и неелектролити. Катиони и аниони.
Електролитна дисоциация на киселини, основи и соли (среда)
Електролити – вещества, които се разпадат на йони във водни разтвори и стопилки, в резултат на което техните водни разтвори или стопилки провеждат електрически ток.
Киселини – електролити, при дисоциацията на които във водни разтвори се образуват като катиони само Н катиони +
Основания – електролити, при дисоциацията на които като аниони се образуват само хидроксидни аниони ОН -
соли среда - електролити, при дисоциация на които се образуват метални катиони и аниони на киселинния остатък.
Катионите имат положителен заряд; аниони – отрицателни
8.
Йонообменни реакции и условия за тяхното провеждане
Йонообменните реакции протичат до край, ако се образува утайка, газ или вода (или друго слабо дисоцииращо вещество).
В йонните уравнения формулите на неелектролитите, неразтворимите вещества, слабите електролити и газовете трябва да се оставят непроменени.
Правила за съставяне на йонни уравнения:
напишете молекулярно уравнение за реакция;
проверете възможността за възникване на реакция;
отбележете веществата (подчертайте), които ще бъдат написани в молекулна форма (прости вещества, оксиди, газове, неразтворими вещества, слаби електролити);
запишете пълното йонно уравнение на реакцията;
зачертайте еднакви йони от лявата и дясната страна;
пренапишете съкратеното йонно уравнение.
9.
Химични свойства на простите вещества: метали и неметали
Само метали, които са отляво на водорода в серията активност, реагират с киселини. Тези. неактивни металиCu, Hg, Ag, Au, Птне реагират с киселини.
Но: Cu , Hg , Ag реагират сHNO 3 конц., разр. , з 2 ТАКА 4 конц.
мех ( Cu, Hg, Ag) +
HNO 3 конц.
→ мех НЕ 3 + НЕ 2 + з 2 О
HNO 3 разредени
→ мех НЕ 3 + НЕ + з 2 О
з 2 ТАКА 4 конц.
→ мех ТАКА 4 + ТАКА 2 + з 2 О
!!! HNO 3 конц. , з 2 ТАКА 4 конц. пасивирамFe, Ал, СЪСr(на не.))
Окислителните свойства на халогените се увеличават в групата отдолу нагоре.
Неметалите реагират с метали и помежду си.
з 2 +Ca →CaH 2
н 2 + 3Ca → Ca 3 н 2
н 2 + О 2 ↔ 2 НЕ
С + О 2 → ТАКА 2
н 2 + 3H 2 → 2NH 3
2P + 3Cl 2 → 2PCl 3 или2P + 5Cl 2 → 2PCl 5
Халогени
1) реагират с алкали:
кл 2 + 2 NaOH → NaCl + NaClO + з 2 О(в студен разтвор)
3 кл 2 + 6 NaOH → NaCl + 5 NaClO 3 + з 2 О(в горещ разтвор)
2) по-активен халоген (по-висок в групата с изключение на флуор, тъй като реагира с вода) измества по-малко активните халогени от техните халогениди. измества халогена надолу по веригата от халогенида.
кл 2 + 2 KBr → бр 2 + 2 KCl, Нобр 2 + KCl ≠
3) 2 Е 2 + О 2 → 2 О +2 Е 2 (кислороден флуорид)
4) Запомнете: 2Fe + 3 кл 2 → 2 Fe +3 кл 3 ИFe + 2 НС1 → Fe +2 кл 2 + з 2
Свойства на металите
Средна активностНеактивен
Cu, Hg, Ag, Au, Пт
1. + з 2 О→ аз* ОХ + з 2 (Добре.)
2.+ неметали
(!2 Na+ О 2 → Na 2 О 2 - кислородна вода)
3.+ киселини
1.+ Н 2 ОТНОСНО (T 0 ) → MeO + з 2
2.+ неметали (с изключение нан 2 )
3. +киселини
4. + сол (разреш.),
5. Аз 1 +Аз 2 О (ако Аз 1 =Мж, Ал)
1. (самоCu, Hg)
+ О 2 (приT 0 )
2. (самоCu, Hg) + кл 2 (приT 0 )
3. + сол (разреш.),ако Ме е по-активен отколкото в солта
10.
Химични свойства на оксидите: основни, амфотерни, киселинни
Химични свойства на оксидите
Нека обозначим активните метали (аз*): Ли, Na, К, Rb, Cs, о, ок, старши, Ба, Ра.
Нека обозначим металите, образуващи амфотерни съединения, като Me А(Zn, Бъда, Ал)
1.+ Н 2 ОТНОСНО2. + киселини (НC.I.и т.н.)
3.+EO
4.+ аз АО
5.+ аз АОн
1. + киселини (HC.I.и т.н.)
2. +редуциращи агенти:
C, CO, N 2 , Ал
3. MgO+ ЕО
1.+ киселини (HC.I.и т.н.)
2.+ аз* О
3.+ аз* Он
4. +редуциращи агенти:
C, CO, N 2 , Ал
5. ZnO+ ЕО
1.+ н 2 ОТНОСНО
2. +Аз*О
+MgO
+ ZnO
3.+ Аз*Он
4. ЕО енергонезависим+ Сол → EO летлив+ сол
Някои функции: 2Mg+ SiO 2 → Si + 2 MgO
4 HF+ SiO 2 → SiF 4 + 2 з 2 О(флуорната киселина "топи" стъкло)
11.
Химични свойства на киселини и основи
Химични свойства на КИСЕЛИНИТЕ:
Взаимодействайтес основни и амфотерни оксиди с образуването на сол и вода: CaO + 2HCl = CaCl 2 +H 2 OZnO+2HNO 3 =Zn(НЕ 3 ) 2 +H 2 О
Взаимодействайтес основи и амфотерни хидроксиди с образуване на сол и вода (реакция на неутрализация):
NaOH + HCl (разреден) = NaCl + H 2 О
Zn(ОХ) 2 + з 2 ТАКА 4 = ZnSO 4 +2 з 2 О
Взаимодействайтесъс соли
А) ако има утаяване или отделяне на газ:
BaCl 2 + з 2 ТАКА 4 =BaSO 4 ↓ + 2HCl
CuS+ з 2 ТАКА 4 = CuТАКА 4 +H 2 С
Б) силните киселини изместват по-слабите от техните соли (ако в реакционната система има малко вода):
2KнО 3тв.+ з 2 ТАКА 4 конц.=К 2 ТАКА 4 + 2 HNО 3
С метали:
А) метали, които са в серията активност, преди водородът да го измести от киселинния разтвор (с изключение на азотната киселина HNO 3 всяка концентрация и концентрирана сярна киселиназ 2 ТАКА 4 )
Б) с азотна киселина и концентрирана сярна киселина реакцията протича по различен начин (вижте свойствата на металите)
12.
Химични свойства на солите
Химични свойства на СОЛТА :
Сол сол.+ сол сол.→ ако се формира ↓
Сол сол.+ база сол.→ ако ↓или (Н.Х. 3 )
Сол . + киселина . → ако се формира ↓or
Сол сол.+ Аз → ако Аз е по-активен отколкото в солта, но не и Аз*
Карбонатите и сулфитите образуват киселинни соли
! CaCO 3 + CO 2 +H 2 O → Ca(HCO 3 ) 2
6. Някои соли се разлагат при нагряване:
1. Карбонати, сулфити и силикати (с изключение на алкални метали) CuCO 3
=CuO+CO 2
2. Нитрати (различните метали се разлагат по различен начин)
T оАЗ НЕ 3 → АЗ НЕ 2 + О 2
Ли , средноактивни метали,Cu
АЗ НЕ 3 → MeO + НЕ 2 + О 2
неактивни метали, с изключение наCu
АЗ НЕ 3 → аз + НЕ 2 + О 2
Н.Х. 4
НЕ 3
→ Н 2
О+2Н 2
О
Н.Х. 4
НЕ 2
→ Н 2
+ 2H 2
О
13.
Чисти вещества и смеси. Правила за безопасна работа в училищна лаборатория. Лабораторна стъклария и оборудване. Човекът в света на веществата, материалите и химичните реакции. Проблеми с безопасната употреба на вещества.
Чисти вещества и смеси
Чистото вещество има определена константасъединение
илиструктура
(сол, захар).
Смесите са физически комбинации от чисти вещества.
Смесите могат да бъдат хомогенни (частици от вещества не могат да бъдат открити)и разнородни.
Смесите могат да бъдат разделени, като се използват техните физични свойства:
Желязото и стоманата се привличат от магнит, други вещества не.
Пясъкът и др. са неразтворими във вода
Натрошена сяра и дървени стърготини изплуват на повърхността на водата
Несмесващите се течности могат да се разделят с помощта на разделителна фуния
Някои правила за безопасна работа в лабораторията:
Носете ръкавици при работа с разяждащи вещества
Получаване на газове като напрТАКА 2 , кл 2 , НЕ 2 , трябва да се извършва само под тяга
Не нагрявайте запалими вещества на открит огън
Когато нагрявате течност в епруветка, първо трябва да загреете цялата епруветка и да я държите под ъгъл 30-45 0
14.
Определяне на естеството на разтворената среда на киселини и основи с
с помощта на индикатори. Качествени реакции към йони в разтвор (хлоридни, сулфатни, карбонатни йони, амониев йон). Получаване на газообразни вещества. Качествени реакции към газообразни вещества (кислород, водород, въглероден диоксид, амоняк)
Получаване на газове
Уравнение на производствената реакцияПреглед
Как да събираме
О 2
2KMnO 4 →К 2 MnO 4 +MnO 2 +О 2 (2 2NH 4 Cl+Ca(OH) 2 → CaCl 2 +2NH 3 +2Н 2 О т 0 )
ПосинявамокърлакмусПарче хартия
Забележка: Н 2 O (+) газът може да бъде събран чрез метод на изместване на водата,
н 2 O(-) не може да се събира чрез изместване на вода
ЛакмусМетил оранжево
Фенолфталеин
червен
Розово
Безцветен
Виолетово
портокал
Безцветен
Син
Жълто
Пурпурен
Тези. не може да се използва за определяне на киселинни условияфенолфталеин!!!
Таблица за определяне на йони
Ag + (AgNO 3 )
Образува се сиренеста бяла утайка, неразтворима в азотна киселина.
бр -
Оформенижълтеникава утайка
аз -
Образува се жълта утайка
П.О. 4 3-
Образува се жълта утайка
ТАКА 4 2-
Ба 2+ (Ba(НЕ 3 ) 2 )
Образува се млечнобяла утайка, неразтворима. нито в киселини, нито в основи
CO 3 2-
з + (НС1)
Силно отделяне на CO газ 2
Н.Х. 4 +
ОХ - (NaOH)
Появява се миризмаН.Х. 3
Fe 2+
Зеленикава утайка↓, кафеникава
Fe 3+
Кафява утайка↓
Cu 2+
Синьо ↓гелообразно
Ал 3+
Бял ↓ гелообразен, разтваря се в излишък от алкали
Zn 2+
ок 2+
CO 3 2- (Na 2 CO 3 )
Бяла утайкаCaCO 3
15.
Изчисляване на масовата част на химичен елемент във вещество
Масовата част на химичния елемент в общата маса на съединенията е равна на съотношението на масата на този елемент към масата на цялото съединение (изразено във фракции от единица или като процент)
ω = нАр(той Х)/г-н(вещества)(×100%)
OGE по химия се полага само по избор на ученика, този тест не е включен в списъка на задължителните. Химия избират ученици, които след 9-ти клас планират да постъпят в специализирано 10-то училище или в специализиран колеж или техникум. За да влезете в медицинско училище, трябва да вземете не само химия, но и биология. Изпитът предполага ориентиране в теорията и успешното й прилагане на практика. Полагащият теста трябва да реши много задачи с различни нива на трудност от широк кръг от теми. За да решите на кои теми да обърнете внимание, прочетете програмата за подготовка на OGE по химия.
Изпитът се състои от задачи, които са разделени на два логически блока:
- Първата част включва задачи за познаване на теорията: тук трябва да дадете кратък отговор - число, поредица от числа, дума.
- Във втората част има няколко въпроса, на които трябва да дадете подробни, пълни отговори, да проведете лабораторен експеримент, да напишете заключения и да извършите изчисления. Изключително важно е да можете да използвате специално оборудване и да използвате алгоритми за решаване на проблеми с различни нива на сложност.
По време на изпита изпитваният има съвети: таблици за разтворимост на соли, киселини, основи във вода, периодична таблица на Менделеев, таблици на метални напрежения. При условие, че знаете как да използвате тези материали, можете да решавате много задачи без затруднения.
- Основният съвет, който е уместен за всеки изпит, е да планирате обучението си. Без ясен план няма да можете да постигнете високо ниво на обучение. За да направите планирането си възможно най-ефективно, проверете– обозначава теми и раздели, на които трябва да обърнете специално внимание.
- Оценете силните си страни: най-лесният начин е онлайн тестване. След преминаване на теста получавате резултата и можете да прецените кои типове задачи и теми ви затрудняват най-много.
- След като идентифицирате проблемните теми, отделете им повече внимание от останалите. За обучение вземете учебници и справочници.
- Не забравяйте да решите проблеми! Колкото повече задачи решите, за да се подготвите, толкова по-лесно ще бъде на изпита.
- Задавайте въпроси: намерете специалист, който може да ви помогне в проблемни ситуации. Това може да е учител или учител. Само специалист може да ви помогне да анализирате грешките си и да не ги допускате отново.
- Научете се да използвате съвети - онези таблици, които можете да вземете със себе си на изпита.
- Изучаването на теория не е достатъчно; много е важно да се практикува извършването на тестове. Тази форма на проверка на знанията създава трудности за мнозина, особено ако не се използва в уроците. Решете повече тестови задачи от различен тип, за да не предизвикват страх и неразбиране по време на изпита.
- „Решаване на OGE по химия“ ще ви помогне да се подготвите за изпита и да го преминете успешно, като използвате определеното време рационално и без стрес.
Справочникът съдържа теоретичен материал за курса по химия и тестови задачи, необходими за подготовка за държавното окончателно сертифициране на OGE на завършилите 9 клас на общообразователните организации. Теорията на курса е изложена в стегната и достъпна форма. Всеки раздел е придружен от примерни тестове. Практическите задачи съответстват на формата OGE. Те дават цялостна представа за видовете задачи в изпитната работа и степента им на трудност. В края на помагалото са дадени отговори на всички задачи, както и необходимите справочни таблици.
Ръководството може да се използва от учениците за подготовка за Единния държавен изпит и самоконтрол и от учителите за подготовка на ученици от начален етап за окончателно атестиране по химия. Книгата е адресирана до студенти, учители и методици.
Ядро на атом. Нуклони. Изотопи.
Атомът е най-малката частица от химически елемент. Дълго време атомите се смятаха за неделими, както се отразява в самото им име („атомос“ на гръцки означава „неразрязан, неделим“). Експериментални изследвания, проведени в края на 19-ти - началото на 20-ти век от известните физици W. Crookes, W.K. Рентген, А. Бекерел, Дж. Томсън, М. Кюри, П. Кюри, Е. Ръдърфорд и други убедително доказват, че атомът е сложна система, състояща се от по-малки частици, първите от които са открити от електрони. В края на 19в. Установено е, че някои вещества при силно осветление излъчват лъчи, представляващи поток от отрицателно заредени частици, наречени електрони (феноменът на фотоелектричния ефект). По-късно беше установено, че има вещества, които спонтанно излъчват не само електрони, но и други частици, не само когато са осветени, но и на тъмно (явлението радиоактивност).
Според съвременните представи в центъра на атома има положително заредено атомно ядро, около което се движат отрицателно заредени електрони по сложни орбити. Размерите на ядрото са много малки - ядрото е приблизително 100 000 пъти по-малко от размера на самия атом. Почти цялата маса на атома е концентрирана в ядрото, тъй като електроните имат много малка маса - те са 1837 пъти по-леки от водороден атом (най-лекият от атомите). Електронът е най-леката известна елементарна частица, масата му е само
9.11 10 -31 кг. Тъй като електрическият заряд на електрона (равен на 1,60 10 -19 C) е най-малкият от всички известни заряди, той се нарича елементарен заряд.
Изтеглете електронната книга безплатно в удобен формат, гледайте и четете:
Изтеглете книгата Химия, Нов пълен справочник за подготовка за OGE, Медведев Ю.Н., 2017 - fileskachat.com, бързо и безплатно изтегляне.
Изтегли pdf
По-долу можете да закупите тази книга на най-добра цена с отстъпка с доставка в цяла Русия.
Типични задачи по химия OGE
В демо версията на OGE 2018 по химия първите 15 задачи са тестови и в отговор на въпроса трябва да изберете един от четирите варианта за отговор.
Не забравяйте, че винаги можете да си уговорите среща с. В нашия учебен център работят най-добрите специалисти!
Упражнение 1
Атомът, показан на фигурата, има 9 електрона, разпределени на две електронни нива, което означава, че е във втория период на периодичната таблица и има пореден номер 9. Този атом е флуор.
Отговор: флуор
Задача 2 в OGE по химия
Неметалните свойства се увеличават с увеличаване на броя на електроните във външното енергийно ниво и с намаляване на броя на енергийните нива. Тоест отляво надясно в период и отдолу нагоре в група. Алуминият, фосфорът и хлорът са в един период и са подредени отляво надясно.
Отговор: алуминий - фосфор - хлор
Задача 3
Йонна връзка се образува между метални и неметални атоми, метална връзка е между метали, а ковалентна връзка е между неметали. Ковалентните връзки се делят на полярни и неполярни. Между два еднакви атома се образува неполярна връзка, като например в молекулата на флуор F-F. А полярната се образува между различни неметални атоми с различни стойности на електроотрицателност.
Отговор: ковалентен неполярен
OGE по химия задача 4
В съединения Na 3 N, NH 3, NH 4 Cl азотът има степен на окисление -3. В HNO2 неговата степен на окисление е +3.
Отговор: HNO2
Задача 5
Цинкът е амфотерен метал, който образува амфотерни оксиди и хидроксиди. Следователно ZnO е амфотерен оксид. Na
2 SO 4 е сол, състояща се от Na катион+ и SO 4 2- анионОтговор: амфотерен оксид и сол
Задача 6
Реакция между меден оксид и водород: CuO + H
2 = Cu + H 2 OCuO е черен прах, получената мед ще бъде червена. Така ще се наблюдава промяна на цвета в резултат на реакцията.
Отговор: промяна на цвета
Задача 7 в OGE по химия
Нека напишем уравнението на дисоциация за всяко от веществата:
H 2 SO 4 = 2H + + SO 4 2-
1 мол сярна киселина се дисоциира на 2 водородни йона и 1 сулфатен йон.
(NH 4 ) 2 S = 2NH 4 + + S 2-
1 мол амониев сулфид се дисоциира на 2 амониеви йона и 1 сулфиден йон.
BaCl 2 = Ba 2+ + 2Cl -
1 мол бариев хлорид се разпада на 1 бариев йон и 2 хлоридни йона
CuSO 4 = Cu 2+ + SO 4 2-
1 мол меден сулфат се дисоциира на 1 меден йон и един сулфатен йон, тоест същия брой молове аниони и катиони.
Отговор: CuSO4
Задача 8
MgCl2 + Ba(NO3)2 = реакцията не настъпва, т.к не се образува газ, утайка или слабо дисоцииращо съединение (вода).
Na 2 CO3 + CaCl 2 = CaCO 3 ↓ + 2NaCl В резултат на реакцията се образува утайка
NH 4 Cl + NaOH = NaCl + NH 3 + H 2 O При реакцията се отделя газ
CuSO 4 + 2KOH = Cu(OH) 2 ↓ + K 2 SO 4 В резултат на реакцията се образува утайка
Отговор: NH4 Cl и NaOH
Задача 9
Cl2 + H2 = 2HC1
Ca + O 2 = CaO
N 2 + H 2 O = не реагират
Fe + S = FeS
Отговор: азот и вода
Задача 11 по химия OGE
Само сребърен нитрат реагира със солна киселина:
AgNO 3 + HCl = AgCl↓ + HNO 3
Реакцията няма да се осъществи с бариев нитрат, тъй като няма да се образува газ, утайка или слабо дисоцииращо съединение (вода).
Солната киселина не реагира с метали, които са в серията от метали след водорода; реакцията също няма да работи със силициев оксид
Отговор: сребърен нитрат
Задача 12
Медният нитрат няма да реагира с натриев хлорид и натриев сулфат, тъй като нито една реакция няма да произведе газ, утайка или слабо дисоцииращо съединение.
И натриевият сулфид с меден нитрат ще реагира по следната схема:
Na 2 S + Cu(NO 3 ) 2 = CuS↓ + 2NaNO 3
Отговор: Не само2 С
Задача 13 в OGE по химия
При никакви обстоятелства счупен живачен термометър или изтекъл живак просто не трябва да се изхвърлят в кошчето. Живакът трябва да се събира в стъклен буркан с плътно затварящ се капак, а стъкленият термометър трябва да се опакова в запечатан найлонов плик. Но това не е вярно.
Солите на тежките метали (включително оловото) имат токсични свойства, така че не се препоръчва да покривате играчки и съдове с тях.
Отговор: само Б
Задача 14
Окислителят в реакциите е елемент, който приема електрони, тоест понижава степента на окисление.
При първата реакция сярата има степен на окисление -2 от лявата страна и 0 отдясно - тоест повишава степента на окисление и е редуциращ агент.
При втората реакция сярата понижава своето окислително число от 0 до -2 и е окислител.
При третата реакция сярата понижава степента на окисление от +2 до +3 и е редуциращ агент.
При четвъртата реакция сярата понижава степента на окисление от 0 до +3 и е редуциращ агент.
Отговор: 3S + 2Al = Al2 С3
Задача 15 в OGE по химия
Амониев фосфат - (NH
4 ) 3 PO 4Моларната му маса е 149 g/mol
Масова част на азота в него = 100%*14*3/149 = 28%
Масова част на кислорода = 100%*16*4/149 = 43%
Масова част на фосфора = 100%*32/149 = 21%
Масова част на водорода = 100%*1*12/149 = 8%
Отговор: 4
OGE по химия част 2
В тестовата част на OGE за 9 клас по химия, задачи 16-19 са въпроси, в отговора на които трябва да запишете правилната последователност от няколко числа. Демо 2018 задачи:
Задача 16
Магнезият и силицийът са разположени в периодичната таблица в третия период, което означава, че имат три електронни слоя в атомите (1) и техните стойности на електроотрицателност са по-малки от тези на фосфора (4), тъй като фосфорът е разположен вдясно в периода и проявява по-изразени неметални свойства от магнезия и силиция.
Отговор: 14
Задача 17 в OGE по химия
Етанолът или етиловият алкохол има формула - С
2 N 5 ТОЙ. Има два въглеродни атома и няма двойни връзки. Етанолът изгаря, за да произвежда въглероден диоксид и вода. 1,2,5 не са правилни.Етанолът е течност, която е силно разтворима във вода при нормални условия. 3 е правилно.
Алкохолите, които включват етанол, претърпяват реакции на заместване с алкални метали (4).
Отговор: 34
Задача 18
Na 2 CO 3 и Na 2 SiO 3 може да се разпознае с помощта на киселина:
Na 2 CO 3 + HCl = NaCl + CO 2 + H 2 O
Na 2 SiO 3 + HCl = NaCl + H 2 SiO 3 ↓
K 2 CO 3 и Li 2 CO 3 може да се разпознае с К 3 PO 4:
K2CO3 + K3PO4 = без реакция
3Li 2 CO 3 + 2K 3 PO 4 = 2Li 3 PO 4 ↓ + 3K 2 CO 3
Na2SO4 и NaOH могат да бъдат разпознати с помощта на CuCl 2 :
Na 2 SO 4 + CuCl 2 = без реакция
2NaOH+ CuCl 2 =Cu(OH)2↓ + 2NaCl
Отговор: 241
OGE по химия задача 19
Сярата може да реагира с концентрирана сярна киселина:
2H 2 SO 4 (конц.) + S = 3SO 2 + 2H 2 O
И с кислород:
S + O 2 = SO 2
Цинковият оксид е амфотерен оксид, следователно може да взаимодейства както с киселини, така и с основи:
ZnO + 2HCl = ZnCl 2 + H 2 O
ZnO + NaOH + H 2 O = Na 2
Алуминиевият хлорид може да реагира със сребърен нитрат и калиев хидроксид:
AlCl 3 + 3AgNO 3 + = Al(NO 3 ) 3 + 3AgCl ↓
3KOH+AlCl3 =3KCl+Al(OH)3 ↓
Отговор: 423
Отговорът на задачи 20-23/24 от демонстрационната версия за OGE OGE 2018 по химия изисква подробен отговор.
Задача 20
Първо трябва да подредите степени на окисление и да намерите елементите, които променят степента на окисление. За тази реакция е йод и сяра.
Уравненията на електронния баланс ще бъдат както следва:
S +6 + 8ē = S –2
Сярата приема електрони и следователно е окислител.
2I –1 – 2ē → I 2 0
Йодът отдава електрони и е редуциращ агент.
След това трябва да „изравните“ електронните полуреакции, като умножите първото уравнение по 4:
S +6 + 8ē = S –2 |*4
2I –1 – 2ē → I 2 0 |*1
8HI + H 2 SO 4 = 4I 2 + H 2 S + 4H 2 O
Задача 21 в OGE по химия
За да се реши задачата, е необходимо да се създаде уравнение на реакцията:
AgNO 3 + NaCl = AgCl↓ + NaNO 3
n (AgCl) = m(AgCl)/M(AgCl) = 8,61 g/143,5 g/mol = 0,06 mol
Количеството на реагиралия сребърен нитрат според уравнението на реакцията е равно на количеството на утаения сребърен хлорид. След това трябва да намерите масата на сребърния нитрат, съдържащ се в първоначалния разтвор:
m(AgNO 3 ) = n(AgNO 3 ) M(AgNO 3 ) = 0,06 mol * 170 g/mol = 10,2 g
Масова част на сребърен нитрат в първоначалния разтвор:
ω(AgNO3) = m(AgNO3 ) / m(разтвор) = 100% * 10,2g / 170g = 6%
В първия изпитен модел на OGE 9 по химия, който включва „мисловен“ експеримент, задача 23 от демонстрационната версия изглежда така:
Fe → FeSO 4 → Fe(OH) 2
2+ + 2OH – = Fe(OH) 2
Вторият изпитен модел на OGE по химия 2018 съдържа реална експериментална задача и съдържа задачи 22 и 23. Задача 22 е теоретичната част за изпълнение на задача 22.
Задача 22 в OGE по химия
Железен (II) хидроксид може да се получи с помощта на предложените реагенти на два етапа съгласно следната схема:
Fe → FeSO 4 → Fe(OH) 2
Или:
CuSO 4 → FeSO 4 → Fe(OH) 2
Реакции, които отговарят на този модел:
1) Fe + CuSO 4 = FeSO 4 + Cu↓
В резултат на реакцията се утаява мед, утайката е червена.
2) FeSO 4 + 2NaOH = Fe(OH) 2 ↓ + Na 2 SO 4
В резултат на втората реакция се образува сиво-зелена утайка от железен (II) хидроксид. Тази реакция е реакция на йонен обмен, съкратеното йонно уравнение ще бъде: Fe
2+ + 2OH – = Fe(OH) 2Задача 23
Отговорът на задача 23 се оценява по два критерия:
Критерий 1оценява съответствието на проведените реакции със схемата, съставена в задача 22 и описанието на промените, настъпващи с веществата:
В резултат на първата реакция Fe + CuSO
4 = FeSO 4 + Cu↓ червената медна утайка, освен това синият цвят на разтвора, характерен за CuSO, изчезва 4В резултат на втората реакция FeSO
4 + 2NaOH = Fe(OH) 2 ↓ + Na 2 SO 4 Железният (II) хидроксид се утаява като сиво-зелен цвят.Също така, при отговора на тази задача е необходимо да се направи заключение за свойствата на веществата и какви реакции са извършени:
Първата реакция е редокс реакция, при която по-активен метал (желязо) замества катиона на по-малко активен метал (Cu
2+ ). Втората реакция е йонообменна реакция между солта и основата, която води до утайка.Критерий 2оценява спазването на общоприетите правила за безопасност по време на лабораторна работа: способността за безопасна работа с химическо оборудване и вещества, например при избора на необходимото количество реагент.