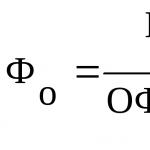Химия. Ново пълно ръководство за подготовка за OGE. Медведев Ю.Н.

М.: 2017. - 320 с.
Новият справочник съдържа целия теоретичен материал по курса по химия, необходим за полагане на основния държавен изпит в 9. клас. Включва всички елементи на съдържанието, проверени с тестови материали, и спомага за обобщаване и систематизиране на знанията и уменията за курса на средното (гимназиалното) училище. Теоретичният материал е изложен в стегната и достъпна форма. Всяка тема е придружена с примерни тестови задачи. Практическите задачи съответстват на формата OGE. В края на помагалото са дадени отговори на тестовете. Наръчникът е предназначен за ученици и учители.
формат: pdf
размер: 4,2 MB
Гледайте, изтеглете:drive.google
СЪДЪРЖАНИЕ
От автора 10
1.1. Структурата на атома. Структурата на електронните обвивки на атомите на първите 20 елемента от периодичната таблица D.I. Менделеева 12
Ядро на атом. Нуклони. Изотопи 12
Електронни черупки 15
Електронни конфигурации на атоми 20
Задачи 27
1.2. Периодичен закон и периодична таблица на химичните елементи D.I. Менделеев.
Физическото значение на поредния номер на химичния елемент 33
1.2.1. Групи и периоди на периодичната таблица 35
1.2.2. Модели на промени в свойствата на елементите и техните съединения във връзка с позицията на химичните елементи в периодичната таблица 37
Промяна на свойствата на елементите в главните подгрупи. 37
Промяна на свойствата на елемента по период 39
Задачи 44
1.3. Структурата на молекулите. Химична връзка: ковалентна (полярна и неполярна), йонна, метална 52
Ковалентна връзка 52
Йонна връзка 57
Метална връзка 59
Задачи 60
1.4. Валентност на химичните елементи.
Степен на окисление на химичните елементи 63
Задачи 71
1.5. Чисти вещества и смеси 74
Задачи 81
1.6. Прости и сложни вещества.
Основни класове неорганични вещества.
Номенклатура на неорганичните съединения 85
Оксиди 87
Хидроксиди 90
Киселини 92
Соли 95
Задачи 97
2.1. Химична реакция. Условия и признаци на химичните реакции. химически
уравнения Запазване на масата на веществата по време на химични реакции 101
Задачи 104
2.2. Класификация на химичните реакции
според различни характеристики: броя и състава на първоначалните и получените вещества, промените в степента на окисление на химичните елементи,
усвояване и освобождаване на енергия 107
Класификация по броя и състава на реактивите и крайните вещества 107
Класификация на реакциите според промените в степента на окисление на химичните елементи HO
Класификация на реакциите по топлинен ефект 111
Задачи 112
2.3. Електролити и неелектролити.
Катиони и аниони 116
2.4. Електролитна дисоциация на киселини, основи и соли (средно) 116
Електролитна дисоциация на киселини 119
Електролитна дисоциация на бази 119
Електролитна дисоциация на соли 120
Електролитна дисоциация на амфотерни хидроксиди 121
Задачи 122
2.5. Йонообменни реакции и условия за тяхното провеждане 125
Примери за съставяне на съкратени йонни уравнения 125
Условия за йонообменни реакции 127
Задачи 128
2.6. Редокс реакции.
Окислители и редуциращи агенти 133
Класификация на редокс реакциите 134
Типични редуциращи и окисляващи агенти 135
Избор на коефициенти в уравненията на редокс реакциите 136
Задачи 138
3.1. Химични свойства на простите вещества 143
3.1.1. Химични свойства на прости вещества - метали: алкални и алкалоземни метали, алуминий, желязо 143
Алкални метали 143
Алкалоземни метали 145
Алуминий 147
Желязо 149
Задачи 152
3.1.2. Химични свойства на прости вещества - неметали: водород, кислород, халогени, сяра, азот, фосфор,
въглерод, силиций 158
Водород 158
Кислород 160
Халогени 162
Сяра 167
Азот 169
Фосфор 170
Въглерод и силиций 172
Задачи 175
3.2. Химични свойства на сложните вещества 178
3.2.1. Химични свойства на оксидите: основни, амфотерни, киселинни 178
Основни оксиди 178
Киселинни оксиди 179
Амфотерни оксиди 180
Задачи 181
3.2.2. Химични свойства на основите 187
Задачи 189
3.2.3. Химични свойства на киселините 193
Общи свойства на киселините 194
Специфични свойства на сярната киселина 196
Специфични свойства на азотната киселина 197
Специфични свойства на ортофосфорната киселина 198
Задачи 199
3.2.4. Химични свойства на солите (средно) 204
Задачи 209
3.3. Взаимоотношение на различни класове неорганични вещества 212
Задачи 214
3.4. Първоначална информация за органични вещества 219
Основни класове органични съединения 221
Основи на теорията за структурата на органичните съединения... 223
3.4.1. Наситени и ненаситени въглеводороди: метан, етан, етилен, ацетилен 226
Метан и етан 226
Етилен и ацетилен 229
Задачи 232
3.4.2. Кислородсъдържащи вещества: алкохоли (метанол, етанол, глицерин), карбоксилни киселини (оцетна и стеаринова) 234
Алкохоли 234
Карбоксилни киселини 237
Задачи 239
4.1. Правила за безопасна работа в училищна лаборатория 242
Правила за безопасна работа в училищна лаборатория. 242
Лабораторна стъклария и оборудване 245
Разделяне на смеси и пречистване на вещества 248
Приготвяне на разтвори 250
Задачи 253
4.2. Определяне на естеството на средата на разтвори на киселини и основи с помощта на индикатори.
Качествени реакции към йони в разтвор (хлоридни, сулфатни, карбонатни йони) 257
Определяне на естеството на средата на разтвори на киселини и основи с помощта на индикатори 257
Качествени реакции на йони
в разтвор 262
Задачи 263
4.3. Качествени реакции към газообразни вещества (кислород, водород, въглероден диоксид, амоняк).
Получаване на газообразни вещества 268
Качествени реакции към газообразни вещества 273
Задачи 274
4.4. Извършване на изчисления по формули и реакционни уравнения 276
4.4.1. Изчисляване на масовата част на химичен елемент във вещество 276
Задачи 277
4.4.2. Изчисляване на масовата част на разтвореното вещество в разтвор 279
Проблеми 280
4.4.3. Изчисляване на количеството вещество, маса или обем на вещество от количеството вещество, маса или обем на един от реагентите
или реакционни продукти 281
Изчисляване на количеството вещество 282
Изчисляване на маса 286
Изчисляване на обем 288
Задачи 293
Информация за два изпитни модела на OGE по химия 296
Указания за изпълнение на експериментална задача 296
Образци на експериментални задачи 298
Отговори на задачи 301
Приложения 310
Таблица за разтворимост на неорганични вещества във вода 310
Електроотрицателност на s- и p-елементи 311
Електрохимични напрежения на метали 311
Някои важни физически константи 312
Префикси при образуване на кратни и подкратни 312
Електронни конфигурации на атоми 313
Най-важните киселинно-алкални показатели 318
Геометричен строеж на неорганични частици 319
За кого са тези тестове?
Тези материали са предназначени за ученици, подготвящи се за OGE-2018 по химия. Те могат да се използват и за самоконтрол при изучаване на училищен курс по химия. Всяка е посветена на конкретна тема, с която деветокласникът ще се срещне на изпита. Номерът на теста е номерът на съответната задача във формата OGE.
Как са структурирани предметните тестове?
Ще има ли други тестове по предмети, публикувани на този сайт?
Несъмнено! Смятам да публикувам тестове по 23 теми по 10 задачи. Останете на линия!
Какво друго има на този сайт за тези, които се подготвят за OGE-2018 по химия?
Чувствате ли, че нещо липсва? Искате ли да разширите някой раздел? Нуждаете се от нови материали? Нещо, което трябва да се поправи? Открихте грешки?
Успех на всички, които се подготвят за Единния държавен изпит и Единния държавен изпит!
Справочникът съдържа теоретичен материал за курса по химия и тестови задачи, необходими за подготовка за държавното окончателно сертифициране на OGE на завършилите 9 клас на общообразователните организации. Теорията на курса е изложена в стегната и достъпна форма. Всеки раздел е придружен от примерни тестове. Практическите задачи съответстват на формата OGE. Те дават цялостна представа за видовете задачи в изпитната работа и степента им на трудност. В края на помагалото са дадени отговори на всички задачи, както и необходимите справочни таблици.
Ръководството може да се използва от учениците за подготовка за Единен държавен изпит и самоконтрол и от учителите за подготовка на ученици от началните класове за окончателна атестация по химия. Книгата е адресирана до студенти, учители и методици.
Ядро на атом. Нуклони. Изотопи.
Атомът е най-малката частица от химически елемент. Дълго време атомите се смятаха за неделими, както се отразява в самото им име („атомос“ на гръцки означава „неразрязан, неделим“). Експериментални изследвания, проведени в края на 19-ти - началото на 20-ти век от известните физици W. Crookes, W.K. Рентген, А. Бекерел, Дж. Томсън, М. Кюри, П. Кюри, Е. Ръдърфорд и други убедително доказват, че атомът е сложна система, състояща се от по-малки частици, първите от които са открити от електрони. В края на 19в. Установено е, че някои вещества при силно осветление излъчват лъчи, представляващи поток от отрицателно заредени частици, наречени електрони (феноменът на фотоелектричния ефект). По-късно беше установено, че има вещества, които спонтанно излъчват не само електрони, но и други частици, не само когато са осветени, но и на тъмно (явлението радиоактивност).
Според съвременните представи в центъра на атома има положително заредено атомно ядро, около което се движат отрицателно заредени електрони по сложни орбити. Размерите на ядрото са много малки - ядрото е приблизително 100 000 пъти по-малко от размера на самия атом. Почти цялата маса на атома е концентрирана в ядрото, тъй като електроните имат много малка маса - те са 1837 пъти по-леки от водороден атом (най-лекият от атомите). Електронът е най-леката известна елементарна частица, масата му е само
9.11 10 -31 кг. Тъй като електрическият заряд на електрона (равен на 1,60 10 -19 C) е най-малкият от всички известни заряди, той се нарича елементарен заряд.
Изтеглете електронната книга безплатно в удобен формат, гледайте и четете:
Изтеглете книгата Химия, Нов пълен справочник за подготовка за OGE, Медведев Ю.Н., 2017 - fileskachat.com, бързо и безплатно изтегляне.
Изтегли pdf
По-долу можете да закупите тази книга на най-добра цена с отстъпка с доставка в цяла Русия.
Задача 1. Строеж на атома. Структурата на електронните обвивки на атомите на първите 20 елемента от периодичната система на Д.И.
Задача 2. Периодичен закон и периодична система на химичните елементи D.I. Менделеев.
Задача 3.Структурата на молекулите. Химична връзка: ковалентна (полярна и неполярна), йонна, метална.
Задача 4.
Задача 5. Прости и сложни вещества. Основни класове неорганични вещества. Номенклатура на неорганичните съединения.
Изтегли:
Преглед:
Упражнение 1
Структурата на атома. Структурата на електронните обвивки на атомите на първите 20 елемента от периодичната система на Д.И.
Как да определим броя на електроните, протоните и неутроните в един атом?
- Броят на електроните е равен на атомния номер и броя на протоните.
- Броят на неутроните е равен на разликата между масовото число и атомното число.
Физическото значение на серийния номер, номера на периода и номера на групата.
- Атомното число е равно на броя на протоните и електроните и заряда на ядрото.
- Номерът на група А е равен на броя на електроните във външния слой (валентни електрони).
Максимален брой електрони в нивата.
Максималният брой електрони на нивата се определя от формулата N= 2· n 2.
Ниво 1 – 2 електрона, ниво 2 – 8, ниво 3 – 18, ниво 4 – 32 електрона.
Особености на запълване на електронните обвивки на елементи от групи А и В.
За елементи от група А валентните (външни) електрони запълват последния слой, а за елементите от група В - външния електронен слой и частично външния слой.
Степени на окисление на елементи във висши оксиди и летливи водородни съединения.
Групи | VIII |
|||||||
ТАКА. във висшия оксид = + № гр | ||||||||
Висш оксид | R 2 O | R2O3 | RО 2 | R2O5 | RO 3 | R 2 O 7 | RO 4 |
|
ТАКА. в LAN = № gr - 8 | ||||||||
LAN | H 4 R | H 3 R | H 2 R |
Структура на електронни обвивки на йони.
Катионът има по-малко електрони на заряд, докато анионите имат повече електрони на заряд.
Например:
Ca 0 - 20 електрона, Ca2+ - 18 електрона;
S 0 – 16 електрона, S 2- - 18 електрона.
Изотопи.
Изотопите са разновидности на атоми на един и същи химичен елемент, които имат еднакъв брой електрони и протони, но различни атомни маси (различен брой неутрони).
Например:
Елементарни частици | Изотопи |
|
40 Ca | 42Ca |
|
Необходимо е да можете да използвате таблицата D.I. Менделеев да определи структурата на електронните обвивки на атомите на първите 20 елемента.
Преглед:
http://mirhim.ucoz.ru
A 2. B 1.
Периодичен закон и периодична система на химичните елементи D.I. Менделеев
Модели на промени в химичните свойства на елементите и техните съединения във връзка с позицията на химичните елементи в периодичната таблица.
Физическото значение на серийния номер, номера на периода и номера на групата.
Атомният (пореден) номер на химичния елемент е равен на броя на протоните и електроните и заряда на ядрото.
Номерът на периода е равен на броя на запълнените електронни слоеве.
Номерът на групата (A) е равен на броя на електроните във външния слой (валентни електрони).
Форми на съществуване химически елементи и техните свойства | Промени в собствеността |
||
В основните подгрупи (отгоре надолу) | В периоди (от ляво на дясно) |
||
Атоми | Основен заряд | Се увеличава | Се увеличава |
Брой енергийни нива | Се увеличава | Не се променя = номер на периода |
|
Брой електрони във външното ниво | Не се променя = номер на периода | Се увеличава |
|
Атомен радиус | Увеличават се | Намалява |
|
Възстановяващи свойства | Увеличават се | Намаляват |
|
Окислителни свойства | Намалява | Увеличават се |
|
Най-високо положително състояние на окисление | Константа = номер на група | Увеличава се от +1 до +7 (+8) |
|
Най-ниска степен на окисление | Не се променя = (8-група №) | Увеличава се от -4 на -1 |
|
Прости вещества | Метални свойства | Се увеличава | Намаляват |
Неметални свойства | Намаляват | Се увеличава |
|
Елементни връзки | Естеството на химичните свойства на висшия оксид и висшия хидроксид | Укрепване на основните свойства и отслабване на киселинните свойства | Засилване на киселинните свойства и отслабване на основните свойства |
Преглед:
http://mirhim.ucoz.ru
A 4
Степен на окисление и валентност на химичните елементи.
Степен на окисление– условният заряд на атом в съединение, изчислен при предположението, че всички връзки в това съединение са йонни (т.е. всички свързващи електронни двойки са напълно изместени към атома на по-електроотрицателен елемент).
Правила за определяне степента на окисление на елемент в съединение:
- ТАКА. свободни атоми и прости вещества е нула.
- Сумата от степени на окисление на всички атоми в едно сложно вещество е нула.
- Металите имат само положителен S.O.
- ТАКА. атоми на алкални метали (I(A) група) +1.
- ТАКА. атоми на алкалоземни метали (II (А) група)+2.
- ТАКА. атоми бор, алуминий +3.
- ТАКА. водородни атоми +1 (в хидриди на алкални и алкалоземни метали –1).
- ТАКА. кислородни атоми –2 (изключения: в пероксиди –1, инОТ 2 +2 ).
- ТАКА. Винаги има 1 атом флуор.
- Степента на окисление на моноатомен йон съответства на заряда на йона.
- Най-висок (максимален, положителен) S.O. елемент е равен на номера на групата. Това правило не важи за елементите от страничната подгрупа на първата група, чиито степени на окисление обикновено надвишават +1, както и за елементите от страничната подгрупа на VIII група. Елементите кислород и флуор също не показват най-високите си степени на окисление, равни на номера на групата.
- Най-нисък (минимален, отрицателен) S.O. за неметални елементи се определя по формулата: номер на група -8.
* ТАКА. – степен на окисление
Валентност на атомае способността на атома да образува определен брой химични връзки с други атоми. Валентността няма знак.
Валентните електрони са разположени на външния слой на елементи от A - групи, на външния слой и d - подниво на предпоследния слой на елементи от B - групи.
Валентности на някои елементи (означени с римски цифри).
постоянен | променливи |
||
ТОЙ | валентност | ТОЙ | валентност |
H, Na, K, Ag, F | Cl, Br, I | I (III, V, VII) |
|
Be, Mg, Ca, Ba, O, Zn | Cu, Hg | II, I |
|
Ал, В | II, III |
||
II, IV, VI |
|||
II, IV, VII |
|||
III, VI |
|||
аз - в |
|||
III, V |
|||
C, Si | IV (II) |
||
Примери за определяне на валентност и S.O. атоми в съединения:
Формула | Валентност | ТАКА. | Структурна формула на веществото |
N III | N N |
||
NF 3 | N III, F I | N +3, F -1 | Ф-Н-Ж |
NH 3 | N III, N I | N -3, N +1 | Н - Н - Н |
H2O2 | H I, O II | H +1, O –1 | Х-О-О-Х |
ОТ 2 | O II, F I | O +2, F –1 | Ф-О-Ф |
*CO | C III, O III | C +2, O –2 | Атомът "C" споделя два електрона, а по-електроотрицателният атом "O" изтегля два електрона към себе си: “C” няма да има желаните осем електрона на външно ниво - четири собствени и два споделени с кислородния атом. Атомът “O” ще трябва да прехвърли една от своите свободни електронни двойки за обща употреба, т.е. действа като донор. Акцепторът ще бъде атомът "С". |
Преглед:
A3. Структурата на молекулите. Химична връзка: ковалентна (полярна и неполярна), йонна, метална.
Химичните връзки са сили на взаимодействие между атоми или групи от атоми, водещи до образуването на молекули, йони, свободни радикали, както и йонни, атомни и метални кристални решетки.
Ковалентна връзкае връзка, която се образува между атоми с еднаква електроотрицателност или между атоми с малка разлика в стойностите на електроотрицателност.
Между атомите на еднакви елементи - неметали се образува ковалентна неполярна връзка. Ковалентна неполярна връзка се образува, ако веществото е просто, напр. O2, H2, N2.
Между атомите на различни елементи - неметали се образува полярна ковалентна връзка.
Полярна ковалентна връзка се образува, ако веществото е сложно, например SO 3, H2O, HCl, NH3.
Ковалентните връзки се класифицират според механизмите на образуване:
обменен механизъм (поради споделени електронни двойки);
донор-акцептор (донорният атом има свободна електронна двойка и я споделя с друг акцепторен атом, който има свободна орбитала). Примери: амониев йон NH 4 +, въглероден окис CO.
Йонна връзка образувани между атоми, които се различават значително по електроотрицателност. Обикновено, когато метални и неметални атоми се комбинират. Това е връзката между различни инфектирани йони.
Колкото по-голяма е разликата в EO на атомите, толкова по-йонна е връзката.
Примери: оксиди, халогениди на алкални и алкалоземни метали, всички соли (включително амониеви соли), всички основи.
Правила за определяне на електроотрицателността от периодичната таблица:
1) отляво надясно през периода и отдолу нагоре през групата, електроотрицателността на атомите се увеличава;
2) най-електроотрицателният елемент е флуорът, тъй като благородните газове имат пълно външно ниво и не са склонни да дават или приемат електрони;
3) неметалните атоми винаги са по-електроотрицателни от металните атоми;
4) водородът има ниска електроотрицателност, въпреки че се намира в горната част на периодичната таблица.
Метална връзка– образува се между метални атоми поради свободни електрони, които задържат положително заредени йони в кристалната решетка. Това е връзката между положително заредените метални йони и електроните.
Вещества с молекулярна структураимат молекулярна кристална решетка,немолекулна структура– атомна, йонна или метална кристална решетка.
Видове кристални решетки:
1) атомна кристална решетка: образува се във вещества с ковалентни полярни и неполярни връзки (C, S, Si), атомите са разположени в местата на решетката, тези вещества са най-твърдите и най-огнеупорни по природа;
2) молекулярна кристална решетка: образува се от вещества с ковалентни полярни и ковалентни неполярни връзки, в местата на решетката има молекули, тези вещества имат ниска твърдост, топими и летливи;
3) йонна кристална решетка: образува се във вещества с йонна връзка, в местата на решетката има йони, тези вещества са твърди, огнеупорни, нелетливи, но в по-малка степен от веществата с атомна решетка;
4) метална кристална решетка: образувани във вещества с метална връзка, тези вещества имат топлопроводимост, електропроводимост, ковкост и метален блясък.
Преглед:
http://mirhim.ucoz.ru
A5. Прости и сложни вещества. Основни класове неорганични вещества. Номенклатура на неорганичните съединения.
Прости и сложни вещества.
Простите вещества се образуват от атоми на един химичен елемент (водород Н 2, азот N 2 , желязо Fe и др.), сложни вещества - атоми на два или повече химични елемента (вода H 2 O – състои се от два елемента (водород, кислород), сярна киселина H 2 SO 4 – образувани от атоми на три химични елемента (водород, сяра, кислород)).
Основни класове неорганични вещества, номенклатура.
Оксиди – сложни вещества, състоящи се от два елемента, единият от които е кислород в степен на окисление -2.
Номенклатура на оксидите
Имената на оксидите се състоят от думите „оксид“ и името на елемента в родителен падеж (което показва степента на окисление на елемента с римски цифри в скоби): CuO – меден (II) оксид, N 2 O 5 – азотен оксид (V).
Характер на оксидите:
ТОЙ | основен | амфотерни | несолеобразуващи | киселина |
метал | S.O.+1,+2 | S.O.+2, +3, +4 амф. Me – Be, Al, Zn, Cr, Fe, Mn | S.O.+5, +6, +7 |
|
неметални | S.O.+1,+2 (без Cl 2 O) | S.O.+4,+5,+6,+7 |
Основни оксиди образуват типични метали с C.O. +1, +2 (Li 2 O, MgO, CaO, CuO и др.). Основни оксиди се наричат оксиди, на които съответстват основите.
Киселинни оксидиобразуват неметали с S.O. повече от +2 и метали със S.O. +5 до +7 (ТАКА 2, SeO 2, P 2 O 5, As 2 O 3, CO 2, SiO 2, CrO 3 и Mn 2 O 7 ). Оксидите, които съответстват на киселини, се наричат киселинни.
Амфотерни оксидиобразувани от амфотерни метали с C.O. +2, +3, +4 (BeO, Cr 2 O 3 , ZnO, Al 2 O 3 , GeO 2 , SnO 2 и PHO). Оксидите, които проявяват химическа двойственост, се наричат амфотерни.
Несолеобразуващи оксиди– неметални оксиди с С.О.+1,+2 (СО, NO, N 2 O, SiO).
Основания ( основни хидроксиди) - сложни вещества, които се състоят от
Метален йон (или амониев йон) и хидроксилна група (-ОН).
Номенклатура на базите
След думата "хидроксид" се посочва елементът и степента му на окисление (ако елементът проявява постоянно състояние на окисление, тогава може да не е посочен):
КОН – калиев хидроксид
Cr(OH) 2 – хром (II) хидроксид
Базите са класифицирани:
1) според тяхната разтворимост във вода основите се разделят на разтворими (алкали и NH 4 OH) и неразтворими (всички други основи);
2) според степента на дисоциация основите се делят на силни (алкали) и слаби (всички останали).
3) по киселинност, т.е. според броя на хидроксогрупите, които могат да бъдат заменени с киселинни остатъци: еднокиселинни (NaOH), двукиселинни, трикиселинни.
Киселинни хидроксиди (киселини)- сложни вещества, които се състоят от водородни атоми и киселинен остатък.
Киселините се класифицират:
а) според съдържанието на кислородни атоми в молекулата - в безкислородни (H° С l) и съдържащи кислород (H 2SO4);
б) по основност, т.е. брой водородни атоми, които могат да бъдат заменени с метал - едноосновен (HCN), двуосновен (H 2 S) и т.н.;
в) според електролитната якост - на силни и слаби. Най-често използваните силни киселини са разредени водни разтвори на HCl, HBr, HI, HNO 3, H2S, HClO4.
Амфотерни хидроксидиобразувани от елементи с амфотерни свойства.
соли - сложни вещества, образувани от метални атоми, комбинирани с киселинни остатъци.
Средни (нормални) соли- железен (III) сулфид.
Киселинни соли - водородните атоми в киселината са частично заменени с метални атоми. Те се получават чрез неутрализиране на основа с излишък от киселина. За правилно имекисела сол, Необходимо е да се добави префиксът хидро- или дихидро- към името на нормална сол, в зависимост от броя на водородните атоми, включени в киселинната сол.
Например KHCO 3 – калиев бикарбонат, KH 2PO 4 – калиев дихидроген ортофосфат
Трябва да се помни, че киселинните соли могат да образуват две или повече основни киселини, както кислородсъдържащи, така и безкислородни киселини.
Основни соли - хидроксилни групи на основата (ОН− ) са частично заменени с киселинни остатъци. Да наименувамосновна сол, необходимо е да се добави префиксът хидроксо- или дихидроксо- към името на нормална сол, в зависимост от броя на ОН групите, включени в солта.
Например (CuOH)2CO3 - меден (II) хидроксикарбонат.
Трябва да се помни, че основните соли могат да образуват само основи, съдържащи две или повече хидроксо групи.
Двойни соли - съдържат два различни катиона; получават се чрез кристализация от смесен разтвор на соли с различни катиони, но еднакви аниони.
Смесени соли - съдържат два различни аниона.
Хидратни соли ( кристални хидрати ) - съдържат кристализационни молекуливода . Пример: Na 2 SO 4 10H 2 O.