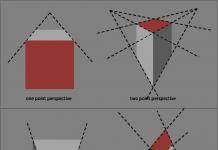
АНТИТЕЛА- протеини от глобулиновата фракция на кръвния серум на хора и топлокръвни животни, образувани в отговор на въвеждането на различни антигени в тялото (бактерии, вируси, протеинови токсини и др.) и специфично взаимодействащи с антигените, които са причинили тяхното образуване . Чрез контакт на активни места (центрове) с бактерии или вируси, антителата предотвратяват тяхното възпроизвеждане или неутрализират токсичните вещества, които отделят. Наличието на антитела в кръвта показва, че тялото е взаимодействало с антиген срещу болестта, която причинява. Степента, в която имунитетът зависи от антителата и до каква степен антителата само придружават имунитета, се решава във връзка с конкретна болест. Определянето на нивото на антителата в кръвния серум дава възможност да се прецени силата на имунитета дори в случаите, когато антителата не играят решаваща защитна роля.
Защитният ефект на антителата, съдържащи се в имунните серуми, се използва широко при терапията и превенцията на инфекциозни заболявания (виж Серопрофилактика, Серотерапия). Реакциите на антитела с антигени (серологични реакции) се използват при диагностицирането на различни заболявания (вижте Серологични тестове).
История
Дълго време за химикала. природата А. знаеше много малко. Известно е, че антителата след прилагане на антигена се намират в кръвния серум, лимфата, тъканните екстракти и че те специфично реагират със своя антиген. Наличието на антитела се преценява въз основа на онези видими агрегати, които се образуват по време на взаимодействие с антигена (аглутинация, преципитация) или по промени в свойствата на антигена (неутрализация на токсина, клетъчен лизис), но почти нищо не се знае за химическия субстрат на антителата...
Чрез използването на ултрацентрофугиране, имуноелектрофореза и протеинова мобилност в изоелектрично поле е доказано, че антителата принадлежат към класа гама глобулини или имуноглобулини.
Антителата са нормални глобулини, образувани по време на синтеза. Имунните глобулини, получени в резултат на имунизация на различни животни с един и същ антиген и при имунизация на един и същ животински вид с различни антигени, имат различни свойства, както и серумните глобулини на различните животински видове не са еднакви.
Класове имуноглобулини
Имуноглобулините се произвеждат от имунокомпетентни клетки на лимфоидните органи, които се различават помежду си според кея. тегло, константа на утаяване, електрофоретична подвижност, съдържание на въглехидрати и имунологична активност. Има пет класа (или типа) имуноглобулини:
Имуноглобулини М (IgM): молекулно тегло около 1 милион, имат сложна молекула; първите, които се появяват след имунизация или антигенна стимулация, имат пагубен ефект върху микробите, които са влезли в кръвния поток, допринасят за тяхната фагоцитоза; по-слаби от имуноглобулините G, те свързват разтворими антигени, бактериални токсини; се разрушават в организма 6 пъти по-бързо от имуноглобулините G (например при плъхове полуживотът на имуноглобулин М е 18 часа, а този на имуноглобулин G е 6 дни).
Имуноглобулини G (IgG): молекулно тегло около 160 000, те се считат за стандартни или класически антитела: лесно преминават през плацентата; се образуват по-бавно от IgM; най-ефективно свързва разтворими антигени, особено екзотоксини, и вируси.
Имуноглобулини А (IgA): молекулно тегло от около 160 000 или повече, произведено от лимфоидната тъкан на лигавиците, предотвратява разграждането на ензимите на телесните клетки и устоява на патогенното действие на чревните микроби, лесно прониква през клетъчните бариери на тялото, съдържа се в коластрата , слюнка, сълзи, чревна слуз, пот, секрет от носа, в кръвта са в по-малки количества, лесно се свързват с клетките на тялото; IgA възникна, очевидно, в процеса на еволюция, за да предпази лигавиците от агресия от бактерии и пасивно предаване на имунитета към потомството.
Имуноглобулини Е (IgE): молекулно тегло около 190 000 (според R.S. Nezlin, 1972); очевидно те са алергични антитела - така наречените реагини (виж по-долу).
Имуноглобулини D (IgD): молекулно тегло около 180 000 (според R.S. Nezlin, 1972); в момента се знае много малко за тях.
Структура на антителата
Имуноглобулиновата молекула се състои от две неидентични полипептидни субединици - леки (L - от английски леки) вериги с молекулно тегло 20 000 и две тежки (H - от английски тежки) вериги с молекулно тегло 60 000. Тези вериги, свързани чрез дисулфидни мостове, образуват основния мономер LH. Такива мономери обаче не се срещат в свободно състояние. Повечето от молекулите на имуноглобулина са съставени от димери (LH) 2, останалите са полимери (LH) 2n. Основните N-терминални аминокиселини на човешкия гама глобулин са аспарагинова и глутаминова киселина, заешки – аланин и аспарагинова киселина. Porter (RR Porter, 1959), действайки върху имуноглобулини с папаин, установи, че те се разпадат на два (I и II) Fab-фрагмента и Fc-фрагмент (III) с константа на утаяване от 3,5S и молекулно тегло около 50 000 въглехидрати, свързани с Fc-фрагмента. По предложение на експертите на СЗО беше установена следната номенклатура на фрагменти от антитяло: Fab-фрагмент - моновалентен, активно свързващ се с антигена; Fc-фрагмент – не взаимодейства с антигена и се състои от С-крайни половини на тежките вериги; Fd фрагмент - участък от тежката верига, включен във Fab фрагмента. Фрагментът от пептична хидролиза на 5S беше предложен да бъде обозначен като F (ab) 2, а моновалентният 3,5S фрагмент беше обозначен като Fab.
Специфичност на антителата
Един от основни свойстваантителата е тяхната специфичност, която се изразява във факта, че антителата по-активно и по-пълно взаимодействат с антигена, с който тялото е било стимулирано. Комплексът антиген-антитяло в този случай има най-голяма сила. Антителата са в състояние да разграничат незначителни структурни промени в антигените. Когато се използват конюгирани антигени, състоящи се от протеин и включен прост химикал, хаптен, получените антитела са специфични за хаптена, протеина и комплекса протеин-хаптен. Специфичността се дължи на химичната структура и пространствения модел на антидетерминантите на антителата (активни центрове, реактивни групи), тоест местата на антителата, чрез които те се свързват с антигенните детерминанти. Броят на антидетерминантните антитела често се нарича тяхната валентност. И така, една молекула на IgM антитяло може да има до 10 валентности, а IgG и IgA антитяло молекули са двувалентни.
Според Караш (F. Karush, 1962), активните центрове на IgG се състоят от 10-20 аминокиселинни остатъка, което е приблизително 1% от всички аминокиселини на молекулата на антитялото, а според Winkler (MN Winkler, 1963) , активните центрове се състоят от 3-4 аминокиселинни остатъка. Те съдържат тирозин, лизин, триптофан и др. Антидетерминантите очевидно са разположени в амино-терминалните половини на Fab-фрагментите. В образуването на активния център участват променливи сегменти от леки и тежки вериги, като последният играе основна роля. Възможно е леката верига да участва само частично в образуването на активния център или да стабилизира структурата на тежките вериги. Най-пълният антидетерминант се създава само от комбинация от леки и тежки вериги. Колкото повече точки на съвпадение на връзката между антидетерминантите на антителата и детерминантите на антигена, толкова по-висока е специфичността. Различната специфичност зависи от последователността на аминокиселинните остатъци в активното място на антителата. Кодирането на огромното разнообразие от антитела по отношение на тяхната специфичност е неясно. Портър признава три възможности за специфичност.
1. Образуването на стабилната част на имуноглобулиновата молекула се контролира от един ген, а променливата част се контролира от хиляди гени. Синтезираните пептидни вериги се обединяват в имуноглобулинова молекула под въздействието на специален клетъчен фактор. Антигенът в този случай действа като фактор, който задейства синтеза на антитела.
2. Имуноглобулинова молекула е кодирана от стабилни и променливи гени. По време на периода на клетъчно делене настъпва рекомбинация на променливи гени, което определя тяхното разнообразие и променливостта на регионите на глобулиновите молекули.
3. Генът, кодиращ променливата част на имуноглобулиновата молекула, се уврежда от специален ензим. Други ензими възстановяват увреждането, но поради грешки позволяват различни нуклеотидни последователности в даден ген. Това е причината за различната последователност от аминокиселини в променливата част на имуноглобулиновата молекула. Има и други хипотези, например. Бърнет (F. M. Burnet, 1971).
Хетерогенността (хетерогенността) на антителата се проявява по много начини. В отговор на въвеждането на един антиген се образуват антитела, които се различават по афинитет към антигена, антигенни детерминанти, молекулно тегло, електрофоретична подвижност и N-терминални аминокиселини. Груповите антитела срещу различни микроби предизвикват кръстосани реакции към различни видове и видове салмонела, шигела, ешерихия, животински протеини, полизахариди. Произведените антитела са хетерогенни по своята специфичност за хомогенен антиген или единична антигенна детерминанта. Хетерогенността на антителата е отбелязана не само срещу протеинови и полизахаридни антигени, но и срещу комплексни, включително конюгирани, антигени и срещу хаптени. Смята се, че хетерогенността на антителата се определя от известната микрохетерогенност на антигенните детерминанти. Хетерогенността може да бъде причинена от образуването на антитела към комплекса антиген-антитяло, което се наблюдава при многократна имунизация, разликата в клетките, които образуват антитела, както и принадлежността на антителата към различни класове имуноглобулини, които, подобно на други протеини, имат сложна антигенна структура, контролирана генетично.
Видове антитела
Пълни антителаимат поне два активни центъра и, когато се комбинират с антигени in vitro, предизвикват видими реакции: аглутинация, преципитация, свързване на комплемента; неутрализират токсините, вирусите, опсонизират бактериите, предизвикват визуален феномен на имунна адхезия, обездвижване, подуване на капсулата, натоварване с тромбоцити. Реакциите протичат в две фази: специфична (взаимодействие на антитяло с антиген) и неспецифична (едно или друго от горните явления). Общоприето е, че различните серологични реакции се дължат на едно, а не на множество антитела и зависят от метода на поставяне. Правете разлика между топли пълни антитела, които реагират с антигена при t ° 37 °, и студени (криофилни), които проявяват ефект при t ° под 37 °. Съществуват и антитела, които реагират с антигена при ниски температури, а видимият ефект се проявява при t ° 37 °; това са бифазни, биотермални антитела, към които се приписват хемолизини на Donat-Landsteiner. Всички известни класове имуноглобулини съдържат пълни антитела. Тяхната активност и специфичност се определят от титъра, авидността (виж Авидитет), броя на антидетерминантите. IgM антителата са по-активни от IgG антителата в реакциите на хемолиза и аглутинация.
Непълни антитела(непреципитиращи, блокиращи, аглутиноиди), подобно на пълните антитела, са способни да се свързват със съответните антигени, но реакцията не е придружена от явлението преципитация, аглутинация и т.н., което е видимо in vitro.
През 1944 г. при хора са открити непълни антитела към антигена Rh; те са открити при вирусни, рикетсиални и бактериални инфекции във връзка с токсини при различни патологични състояния. Има някои доказателства за бивалентността на непълните антитела. Бактериалните непълни антитела имат защитни свойства: антитоксични, опсонизиращи, бактериологични; в същото време са открити непълни антитела при редица автоимунни процеси – при заболявания на кръвта, особено хемолитични анемии.
Непълните хетеро-, изо- и автоантитела могат да причинят увреждане на клетките и също така играят роля в появата на лекарствено-индуцирана левко- и тромбоцитопения
Нормалните (естествени) антитела се считат за обикновено открити в серума на животни и хора при липса на явна инфекция или имунизация. Произходът на антибактериалните нормални антитела може да бъде свързан по-специално с антигенна стимулация от нормалната микрофлора на тялото. Тези възгледи са теоретично и експериментално обосновани от изследвания върху гнотобионтни животни и новородени при нормални условия на местообитание. Въпросът за функциите на нормалните антитела е пряко свързан със спецификата на тяхното действие. LA Zilber (1958) смята, че индивидуалната резистентност към инфекции и, в допълнение, "имуногенната готовност на организма" се определят от тяхното присъствие. Показана е ролята на нормалните антитела в кръвната бактерицидна активност, в опсонизацията по време на фагоцитоза. Работата на много изследователи е показала, че нормалните антитела са предимно макроглобулини - IgM. Някои изследователи са открили нормални антитела в IgA и IgG класовете имуноглобулини. Те могат да съдържат както непълни, така и пълни антитела (нормални антитела към еритроцитите – вижте Кръвни групи).
Синтез на антитела
Синтезът на антитела протича в две фази. Първата фаза е индуктивна, латентна (1-4 дни), в която не се откриват антитела и антитяло-продуциращи клетки; втората фаза е продуктивна (започва след индуктивната фаза), антитела се откриват в плазмените клетки и течността, изтичаща от лимфоидните органи. След първата фаза на образуване на антитела започва много бърз темп на растеж на антителата, често съдържанието им може да се удвои на всеки 8 часа и дори по-бързо. Максималната концентрация на различни антитела в кръвния серум след еднократна имунизация се регистрира на 5-ия, 7-ия, 10-ия или 15-ия ден; след инжектиране на депозирани антигени - на 21-30-ия или 45-ия ден. След това, след 1-3 месеца или повече, титрите на антителата намаляват рязко. Въпреки това, понякога ниско нивоантителата след имунизация се регистрират в кръвта в продължение на няколко години. Установено е, че първичната имунизация с голям брой различни антигени е придружена от появата на първо тежки IgM (19S) антитела, след това за кратко време IgM и IgG (7S) антитела и накрая малко 7S антитела. Многократното стимулиране на сенсибилизирания организъм с антиген ускорява образуването на двата класа антитела, съкращава латентната фаза на образуване на антитела, периода на синтез на 19S антитела и насърчава преференциалния синтез на 7S антитела. Често 19S антителата изобщо не се появяват.
Изразени разлики между индуктивната и продуктивната фаза на образуване на антитела се установяват при изследването на тяхната чувствителност към редица влияния, което е от основно значение за разбирането на същността на специфичната профилактика. Например, известно е, че радиацията преди имунизацията забавя или напълно инхибира производството на антитела. Облъчването по време на репродуктивната фаза на производство на антитела не влияе върху нивото на антителата в кръвта.
Изолиране и пречистване на антитела
За подобряване на метода за изолиране и пречистване на антитела са предложени имуносорбенти. Методът се основава на транслацията на разтворими антигени в неразтворими антигени чрез свързването им ковалентни връзкикъм неразтворима основа от целулоза, сефадекс или друг полимер. Методът дава възможност да се получат високо пречистени антитела в големи количества. Процесът на изолиране на антитела с помощта на имуносорбенти включва три етапа:
1) извличане на антитела от имунен серум;
2) промиване на имуносорбента от неспецифични протеини;
3) разцепване на антитела от измития имуносорбент (обикновено буферни разтвори с ниски стойности на рН). В допълнение към този метод са известни и други методи за пречистване на антитела. Те могат да бъдат разделени на две групи: специфични и неспецифични. Първият се основава на дисоциацията на антитела от неразтворимия комплекс антиген-антитяло (преципитат, аглутинат). Осъществява се от различни вещества; широко разпространен метод за ензимно смилане на антиген или флокулиран токсин - антитоксин амилаза, трипсин, пепсин. Термичното елуиране също се използва при t ° 37-56 °.
Неспецифичните методи за пречистване на антитела се основават на изолирането на гама глобулини: гел електрофореза, хроматография върху йонообменни смоли, фракциониране чрез гел филтрация през Sephadex. Методът на утаяване с натриев сулфат или амоний е широко известен. Тези методи са полезни в случаи на високи серумни концентрации на антитела, като хиперимунизация.
Филтрацията с гел през сефадекси, както и използването на йонообменни смоли, правят възможно разделянето на антителата според размера на техните молекули.
Използване на антитела
Антителата, особено гама глобулините, се използват за лечение и профилактика на дифтерия, морбили, тетанус, газова гангрена, антракс, лептоспироза, срещу стафилококи, патогени на бяс, грип и др. Специално приготвени и пречистени диагностични серуми се използват за серологична идентификация на патогени (вж. Идентифициране на микроби). Установено е, че пневмококи, стафилококи, салмонела, бактериофаги и др., чрез адсорбиране на съответните антитела, прилепват към тромбоцитите, еритроцитите и други чужди частици. Това явление се нарича имунна адхезия. Показано е, че протеиновите рецептори на тромбоцитите и еритроцитите, които се разрушават от трипсин, папаин и формалин, играят роля в механизма на това явление. Отговорът на имунната адхезия зависи от температурата. Той се взема предвид чрез адхезията на корпускуларен антиген или чрез хемаглутинация, причинена от разтворим антиген в присъствието на антитела и комплемент. Реакцията е силно чувствителна и може да се използва както за определяне на комплемента, така и за много малки (0,005-0,01 μg азот) количества антитела. Имунната адхезия засилва фагоцитозата от левкоцити.
Съвременни теории за образуване на антитела
Има поучителни теории за образуването на антитела, според изрязания антиген пряко или косвено участва в образуването на специфични имуноглобулини, както и теории, предполагащи образуването на генетично съществуващи антитела към всички възможни антигени или клетки, синтезиращи тези антитела. Те включват теориите за селекция и теорията на репресията - дерепресия, която позволява на една клетка да синтезира всякакви антитела. Предлагат се и теории, които се стремят да осмислят процесите на имунологичния отговор на нивото на целия организъм, като се вземат предвид взаимодействието на различни клетки и общоприетите идеи за протеиновия синтез в организма.
Теория на директната матрица на Гаувиц-Паулингсе свежда до факта, че антигенът, влизайки в клетките, които произвеждат антитела, играе ролята на матрица, влияеща върху образуването на имуноглобулинова молекула от пептидни вериги, чийто синтез протича без участието на антигена. "Интервенцията" на антигена се случва само във втората фаза на образуването на протеиновата молекула - фазата на усукване на пептидните вериги. Антигенът променя крайните N-аминокиселини на бъдещото антитяло (имуноглобулин или неговите отделни пептидни вериги) по такъв начин, че те стават комплементарни на антигенните детерминанти и лесно се свързват с него. Образуваните по този начин антитела се отделят от антигена, навлизат в кръвния поток и освободеният антиген участва в образуването на нови молекули на антитела. Тази теория предизвика редица сериозни възражения. Не може да обясни формирането на имунологична толерантност; превъзходното количество антитела, произведени от клетката за единица време за многократно по-малкия брой антигенни молекули, налични в нея; продължителността на производството на антитела от организма, изчислена в години или през целия живот, в сравнение с много по-кратък период на запазване на антигена в клетките и т.н. фрагменти в клетки, синтезиращи антитяло, не могат да бъдат напълно изключени. Наскоро F. Haurowitz (1965) предложи нова концепция, според която антигенът променя не само вторичната, но и първичната структура на имуноглобулина.
Непряката матрица на Бърнет - Фенерпридобива известност през 1949 г. Неговите автори смятат, че макромолекулите на антигена и най-вероятно неговите детерминанти проникват в ядрата на клетките от зародишния тип и причиняват наследствено фиксирани промени в тях, резултатът от които е образуването на антитела към този антиген. Допуска се аналогия между описания процес и трансдукцията в бактерии. Новото качество на образуването на имуноглобулини, придобити от клетките, се предава на потомството на клетките в безброй поколения. Въпросът за ролята на антигена в описания процес обаче се оказва спорен.
Това обстоятелство е причината за появата на теорията за естествения подбор на Ерне (K. Jerne, 1955).
Теорията на Ерн за естествения подбор.Според тази теория антигенът не е матрица за синтез на антитела и не причинява генетични промени в клетките, произвеждащи антитела. Ролята му се свежда до избора на налични "нормални" антитела, които възникват спонтанно към различни антигени. Изглежда се случва така: антигенът, влизайки в тялото, намира съответното антитяло, комбинира се с него; полученият комплекс антиген-антитяло се абсорбира от клетките, които произвеждат антитела, а последните се стимулират да произвеждат антитела точно от този вид.
Теория на клоновата селекция на Бърнет (F. Burnet) беше по-нататъшно развитие на идеята на Ерн за селекция, но не на антитела, а на клетки, които произвеждат антитела. Бърнет смята, че в резултат на общия процес на диференциация в ембрионалния и постнаталния период от мезенхимни клетки се образуват много клонове на лимфоидни или имунологично компетентни клетки, способни да реагират с различни антигени или техни детерминанти и да произвеждат антитела – имуноглобулини. Характерът на отговора на лимфоидните клетки към антигена в ембрионалния и постнаталния период е различен. Ембрионът или изобщо не произвежда глобулини, или ги синтезира малко. Предполага се обаче, че онези негови клонинги на клетки, които са способни да реагират с антигенни детерминанти на собствените си протеини, реагират с тях и в резултат на тази реакция се унищожават. Така че е вероятно клетките, които образуват анти-А-аглутинини при хора с кръвна група А и анти-В-аглутинини при хора с кръвна група В, да умрат. Ако на ембрион се инжектира някакъв антиген, той по подобен начин ще унищожи съответния клон на клетките и новороденото през целия следващ живот теоретично ще бъде толерантно към този антиген. Процесът на унищожаване на всички клонове на клетки до собствените протеини на ембриона приключва до момента на неговото раждане или освобождаване от яйцеклетката. Сега новороденото има само „свои“ и разпознава всяко „чуждо“, което е влязло в тялото му. Бърнет също така признава запазването на "забранени" клонове на клетки, способни да реагират с автоантигени на органи, които са били изолирани от клетки, които произвеждат антитела по време на развитието. Разпознаването на „чуждото” се осигурява от останалите клонове на мезенхимни клетки, на повърхността на които има съответни антидетерминанти (рецептори, клетъчни антитела), комплементарни на детерминантите на „чуждия” антиген. Природата на рецепторите е генетично детерминирана, тоест те са кодирани в хромозомите и не се въвеждат в клетката заедно с антигена. Наличието на готови рецептори неизбежно води до реакция на даден клон от клетки с даден антиген, което вече води до два процеса: образуване на специфични антитела – имуноглобулини и размножаване на клетките на този клон. Бърнет признава, че мезенхимна клетка, която е получила антигенна стимулация, води до популация от дъщерни клетки в реда на митоза. Ако такава клетка се е настанила в медулата на лимфния възел, тя поражда образуването на плазмени клетки, докато се установява в лимфните фоликули - лимфоцити, в костния мозък - еозинофили. Дъщерните клетки са предразположени към необратими соматични мутации. Когато се изчисли за целия организъм, броят на мутиращите клетки на ден може да бъде 100 000 или 10 милиона и следователно мутациите ще осигурят клетъчни клонинги на всеки антиген. Теорията на Бърнет предизвика голям интерес сред изследователите и голям брой експерименти за проверка. Най-важното потвърждение на теорията беше доказателството за наличието на антитяло-подобни рецептори от имуноглобулинова природа върху прекурсорите на клетки, произвеждащи антитяло (лимфоцити от костен мозък) и наличието на интерцистронен механизъм за изключване в клетките, произвеждащи антитяло по отношение на антитела с различна специфичност.
Теорията за репресията и дерепресията е формулирана от Силард(L. Szilard) през 1960г. Според тази теория всяка клетка, която произвежда антитяло, може потенциално да синтезира всяко антитяло срещу всеки антиген, но този процес се инхибира от репресор на ензим, участващ в синтеза на имуноглобулин. От своя страна, образуването на репресор може да бъде инхибирано от влиянието на антиген. Силард смята, че образуването на антитела се контролира от специални гени, които се провалят. Техният брой достига 10 000 за всеки единичен (хаплоиден) набор от хромозоми.
Ледерберг(J. Lederberg) смята, че в гените, отговорни за синтеза на глобулини, има региони, които контролират образуването на активни центрове на антитела. Обикновено функцията на тези области е инхибирана и следователно се осъществява синтеза на нормални глобулини. Под влияние на антигена, а също и, вероятно, под действието на някои хормони, настъпва деинхибиране и стимулиране на активността на генните области, отговорни за образуването на активни центрове на антитела, и клетката започва да синтезира имуноглобулини.
Според Х. Н. Жукова-Вережникова(1972), еволюционните предшественици на антителата са защитни ензими, подобни на тези, които се появяват в бактерии с придобита антибиотична резистентност. Подобно на антителата, ензимите се състоят от активни (по отношение на субстрата) и пасивни части на молекулата. Поради икономичността си, механизмът „един ензим – един субстрат“ беше заменен от механизма на „единични молекули с променлива част“, тоест антитела с променлива активни центрове... Информацията за производството на антитела се реализира в зоната на "резервните гени", или в "зоната на излишък" върху ДНК. Такава излишество, очевидно, може да бъде локализирана в ядрената или плазмидната ДНК, която съхранява "еволюционна информация... която играе ролята на вътрешен механизъм, който" грубо "контролира наследствената вариабилност". Тази хипотеза съдържа поучителен компонент, но не е напълно поучителен.
P.F.Zdrodovskyприписва на антигена ролята на дерепресор на определени гени, които контролират синтеза на комплементарни антитела. В същото време антигенът, както Здродовски признава в съответствие с теорията на Selye, дразни аденохипофизата, което води до производството на соматотропни (STH) и адренокортикотропни (ACTH) хормони. STH стимулира плазмоцитните и антитялообразуващи реакции на лимфоидните органи, които от своя страна се стимулират от антигена, а ACTH, действайки върху кората на надбъбречната жлеза, я кара да отделя кортизон. Последният в имунния организъм инхибира плазмоцитната реакция на лимфоидните органи и синтеза на антитела от клетките. Всички тези положения са потвърдени експериментално.
Действието на системата хипофиза-надбъбречна жлеза върху производството на антитела може да бъде открито само в имунизиран преди това организъм. Именно тази система организира анамнестични серологични реакции в отговор на въвеждането на различни неспецифични дразнители в тялото.
Задълбочено изследване на клетъчните промени в процеса на имунологичен отговор и натрупването на голям брой нови факти обоснова позицията, според която имунологичният отговор се осъществява само в резултат на кооперативното взаимодействие на определени клетки. В съответствие с това са предложени няколко хипотези.
1. Теорията на сътрудничеството на две клетки. Натрупани са много факти, които показват, че имунната реакция в организма се осъществява в условията на взаимодействие на различни видове клетки. Има доказателства, че макрофагите са първите, които усвояват и модифицират антигена, но впоследствие „инструктират“ лимфоидните клетки да синтезират антитела. В същото време беше показано, че съществува сътрудничество между лимфоцити, принадлежащи към различни субпопулации: между Т-лимфоцити (зависими от тимуса, антине-реактивни, произхождащи от тимусната жлеза) и В клетки (тимус-независими, прекурсори на антитяло- образуващи клетки, костномозъчни лимфоцити).
2. Теории за сътрудничество на три клетки. Според възгледите на Roitt (I. Roitt) и други (1969) антигенът се улавя и обработва от макрофагите. Този антиген стимулира антиген-реактивните лимфоцити, които претърпяват трансформация в бластоидни клетки, осигурявайки свръхчувствителност от забавен тип и се трансформират в дългоживеещи клетки с имунологична памет. Тези клетки влизат в сътрудничество с прогениторни клетки, произвеждащи антитяло, които от своя страна се диференцират, пролиферирайки в клетки, произвеждащи антитяло. Според Рихтер (M. Richter, 1969), повечето антигени имат слаб афинитет към клетки, образуващи антитяло, следователно, за производството на антитела е необходимо следното взаимодействие на процеси: антиген + макрофаг - обработен антиген + антиген-реактивна клетка - активиран антиген + прекурсор на антитялообразуващи клетки - антитела. В случай на висок афинитет на антигена, процесът ще изглежда така: антиген + прекурсор на антитялообразуващи клетки - антитела. Предполага се, че при условия на многократна стимулация с антиген, последният директно влиза в контакт с клетка, образуваща антитяло, или клетка с имунологична памет. Тази позиция се потвърждава от по-високата радиорезистентност на повторния имунологичен отговор от първичния, което се обяснява с различната резистентност на клетките, участващи в имунологичния отговор. Постулирайки необходимостта от триклетъчно сътрудничество в антителогенезата, Р. В. Петров (1969, 1970) смята, че синтезът на антитела ще се случи само ако стволовата клетка (предшественикът на клетката, образуваща антитяло) едновременно получи обработен антиген от макрофага, и индуктор на имунопоеза от антиген-реактивната клетка, образувана след нейната (антиген-реактивна клетка) стимулация с антиген. Ако стволовата клетка влезе в контакт само с антигена, обработен от макрофага, тогава се създава имунологична толерантност (вижте Толерантност имунологична). Ако има контакт на стволовата клетка само с антиген-реактивна клетка, тогава се получава синтеза на неспецифичен имуноглобулин. Предполага се, че тези механизми са в основата на инактивирането на несингенни стволови клетки от лимфоцити, тъй като индуктор на имунопоеза, навлизайки в алогенна стволова клетка, е антиметаболит за нея (сингенни - клетки с идентичен геном, алогенни - клетки от същия геном). тип, но с различен генетичен състав) ...
Алергични антитела
Алергичните антитела са специфични имуноглобулини, образувани от алергени при хора и животни. Това се отнася до антитела, циркулиращи в кръвта в случай на незабавни алергични реакции. Има три основни типа алергични антитела: сенсибилизиращи кожата или реагини; блокиране и хемаглутиниране. Биологичните, химичните и физикохимичните свойства на човешките алергични антитела са особени ( раздел.).
Тези свойства се различават рязко от свойствата на преципитиращите, комплемент-свързващите антитела, аглутинините и други, описани в имунологията.
Реагините обикновено се използват за обозначаване на хомоложни сенсибилизиращи кожата човешки антитела. Това е най-важният тип човешки алергични антитела, чието основно свойство е способността да извършват реакция на пасивно пренасяне на свръхчувствителност към кожата на здрав реципиент (виж реакцията на Prausnitz-Küstner). Реагините имат редица характерни свойства, които ги отличават от сравнително добре проучените имунни антитела. Въпреки това, много въпроси относно свойствата на реагините и тяхната имунологична природа остават неразрешени. По-специално, не е решен въпросът за хомогенността или хетерогенността на реагините в смисъла на тяхната принадлежност към определен клас имуноглобулини.
Блокиращи антитела възникват при пациенти с полиноза в процеса на специфична хипосенсибилизираща терапия към антигена, с който се извършва хипосенсибилизацията. Свойствата на този тип антитела наподобяват тези на преципитиращите антитела.
Под хемаглутиниращи антитела обикновено се разбират човешки и животински серумни антитела, способни специфично да аглутинират еритроцити, свързани с поленов алерген (реакция на непряка или пасивна хемаглутинация). Свързването на повърхността на еритроцитите с поленовия алерген се постига чрез различни методи, например с помощта на танин, формалин, двойно диазотиран бензидин. Хемаглутиниращи антитела могат да бъдат открити при хора с повишена чувствителност към растителен прашец, както преди, така и след специфична хипосенсибилизираща терапия. В хода на тази терапия се получава трансформация на отрицателните реакции в положителни или повишаване на титрите на реакцията на хемаглутинация. Хемаглутиниращите антитела имат способността да се адсорбират доста бързо върху еритроцити, третирани с поленов алерген, особено някои от неговите фракции. Имуносорбентите премахват хемаглутиниращите антитела по-бързо от реагините. Хемаглутиниращата активност е свързана до известна степен с кожно-сенсибилизиращи антитела, но ролята на кожно-сенсибилизиращите антитела в хемаглутинацията изглежда незначителна, тъй като няма корелация между сенсибилизиращите кожата и хемаглутиниращите антитела. От друга страна, има корелация между хемаглутиниращи и блокиращи антитела както при индивиди с алергия към растителен прашец, така и при здрави индивиди, имунизирани с растителен прашец. Тези два типа антитела споделят много от същите свойства. В процеса на специфична хипосенсибилизираща терапия се повишава нивото както на единия, така и на другия тип антитела. Хемаглутиниращите антитела към пеницилин не са идентични с сенсибилизиращите кожата антитела. Основната причина за образуването на хемаглутиниращи антитела е терапията с пеницилин. Очевидно хемаглутиниращите антитела трябва да се причислят към групата антитела, наричани от някои автори като "свидетелски антитела".
През 1962 г. W. Shelley предлага специален диагностичен тест, основан на т. нар. дегранулация на базофилни левкоцити от заешка кръв под действието на алергенна реакция със специфични антитела. Въпреки това, естеството на антителата, които участват в тази реакция, и връзката им с циркулиращите реагини не са добре разбрани, въпреки че има данни за корелацията на този тип антитела с нивото на реагините при пациенти със сенна хрема.
Установяването на оптимални съотношения на алерген и тест серум е изключително важно в практическо отношение, особено при проучвания с видове алергени, информация за които все още не се съдържа в съответната литература.
Алергичните антитела на животни включват следните видове антитела: 1) антитела при експериментална анафилаксия; 2) антитела за спонтанни алергични заболявания на животни; 3) антитела, които играят роля в развитието на реакцията на Артус (преципитиращ тип). При експериментална анафилаксия, както обща, така и локална, в кръвта на животните се откриват специални видове анафилактични антитела, които имат свойството пасивно да сенсибилизират кожата на животни от същия вид.
Доказано е, че анафилактичната сенсибилизация на морски свинчета към поленовите алергени от тимотейска трева се съпровожда от циркулация на кожно-сенсибилизиращи антитела в кръвта.Тези кожно-сенсибилизиращи тела имат способността да извършват хомоложна пасивна кожна сенсибилизация in vivo. Заедно с тези хомоложни сенсибилизиращи кожата антитела по време на обща сенсибилизация на морски свинчета към поленовите алергени от тимотейска трева, в кръвта циркулират антитела, открити чрез реакция на пасивна хемаглутинация с бис-диазотизиран бензидин. Кожно-сенсибилизиращите антитела, които извършват хомоложен пасивен трансфер и имат положителна корелация с индекса на анафилаксия, се отнасят към групата на хомоложните анафилактични антитела или хомоцитотропните антитела. Използвайки термина "анафилактични антитела", авторите им приписват водеща роля в реакцията на анафилаксията. Започнаха да се появяват проучвания, потвърждаващи съществуването на хомоцитотропни антитела срещу протеинови антигени и конюгати в различни видове опитни животни. Редица автори разграничават три типа антитела, участващи в алергични реакции от незабавен тип. Това са антитела, свързани с нов тип имуноглобулини (IgE) при хора и подобни антитела при маймуни, кучета, зайци, плъхове и мишки. Вторият тип антитела са антитела от типа на морско свинче, които могат да бъдат фиксирани върху мастоцити и изологични тъкани. Те се различават по редица свойства, по-специално те са по-термично стабилни. Смята се, че антителата от типа IgG могат да бъдат вторият тип анафилактични антитела при хора. Третият тип са антитела, които сенсибилизират хетероложни тъкани, принадлежащи например при морски свинчета към γ 2 клас. При хората само антитела от типа IgG имат способността да сенсибилизират кожата на морското свинче.
При заболявания на животните са описани алергични антитела, които се образуват при спонтанни алергични реакции. Тези антитела са термолабилни и имат сенсибилизиращи кожата свойства.
Непълните антитела в съдебната медицина се използват при определяне на антигени на редица изосерологични системи (виж Кръвни групи) за установяване принадлежността на кръв към определено лице в случаи на престъпления (убийство, сексуални престъпления, пътнотранспортни произшествия, телесна повреда, и др.), както и при разглеждане на спорни бащинство и майчинство. За разлика от пълните антитела, те не аглутинират червените кръвни клетки във физиологична среда. Сред тях се разграничават антитела от два типа. Първият от тях са аглутиноидите. Тези антитела са способни да причинят адхезия на червените кръвни клетки в протеинова или макромолекулна среда. Вторият тип антитела са криптаглутиноидите, които реагират при индиректен тест на Кумбс с антигамаглобулин серум.
За работа с непълни антитела са предложени редица методи, които са разделени в три основни групи.
1. Методи на конглутинация. Отбелязва се, че непълните антитела са способни да причинят аглутинация на еритроцитите в протеинова или макромолекулна среда. Като такава среда се използват кръвен серум от група АВ (несъдържащ антитела), говежди албумин, декстран, биогел - особено пречистен желатин, коригиран до неутрално рН с буферен разтвор и др. (вж. Конглутинация).
2. Ензимни методи. Непълните антитела могат да причинят аглутинация на еритроцити, които са били предварително третирани с някои ензими. За такава обработка се използват трипсин, фицин, папаин, екстракти от хлебна мая, протелин, бромелин и др.
3. Тест на Кумбс с антиглобулинов серум (вж. Реакция на Кумбс).
Непълните антитела, свързани с аглутиноидите, могат да проявят ефекта си и в трите групи методи. Антителата, свързани с криптаглутиноидите, не са в състояние да аглутинират еритроцитите не само във физиологичен разтвор, но и в макромолекулна среда, а също и да ги блокират в последната. Тези антитела се отварят само при индиректния тест на Кумбс, с помощта на който се отварят не само антитела, свързани с криптаглутиноидите, но и антитела, които са аглутиноиди.
Моноклонални антитела
От допълнителни материали, том 29
Класическият метод за производство на антитела за диагностични и изследователски цели е да се имунизират животни с определени антигени и след това да се получат имунни серуми, съдържащи антитела с необходимата специфичност. Този метод има редица недостатъци, свързани преди всичко с факта, че имунните серуми включват хетерогенни и хетерогенни популации от антитела, които се различават по активност, афинитет (афинитет към антигена) и биологично действие. Обикновените имунни серуми съдържат смес от антитела, специфични както за даден антиген, така и за протеинови молекули, които го замърсяват. Нов вид имунологични реагенти са моноклоналните антитела, получени с помощта на клонове на хибридни клетки - хибридоми (вж.). Безспорното предимство на моноклоналните антитела е техният генетично предопределен стандарт, неограничена възпроизводимост, висока чувствителност и специфичност. Първите хибридоми са изолирани в началото на 70-те години на 20-ти век, но истинското развитие на ефективна технология за създаване на моноклонални антитела е свързано с изследванията на G. Kohler, S. Milstein, резултатите от които са публикувани през 1975 г. 1976 г. През следващото десетилетие се развива ново направление в клетъчното инженерство, свързано с производството на моноклонални антитела.
Хибридомите се образуват, когато лимфоцитите на хиперимунизирани животни се сливат с клетки, трансплантирани от плазмоцити от различен произход. Хибридомите наследяват от единия родител способността да произвеждат специфични имуноглобулини, а от другия - способността да се размножават неограничено. Клонираните популации от хибридни клетки могат да произвеждат генетично хомогенни имуноглобулини с дадена специфичност – моноклонални антитела – за дълго време. Най-широко използваните моноклонални антитела, произведени от хибридоми, получени с помощта на уникалната миша клетъчна линия MORS 21 (R3).
Неразрешимите проблеми на технологията за моноклонални антитела включват сложността и трудоемостта при получаването на стабилни, високопродуктивни хибридни клонове, които произвеждат моноспецифични имуноглобулини; трудността при получаване на хибридоми, произвеждащи моноклонални антитела срещу слаби антигени, неспособни да индуцират образуването на стимулирани В-лимфоцити в достатъчен брой; липсата на определени свойства на имунните серуми в моноклоналните антитела, например, способността да образуват преципитати с комплекси от други антитела и антигени, на които се основават много диагностични тестови системи; ниска честота на сливане на антитяло-продуциращи лимфоцити с миеломни клетки и ограничена стабилност на хибридоми в масови култури; ниска стабилност по време на съхранение и повишена чувствителност на препаратите от моноклонални антитела към промени в pH, температурата на инкубация, както и към замразяване, размразяване и излагане на химични фактори; трудността при получаване на хибридоми или трансплантируеми производители на човешки моноклонални антитела.
Почти всички клетки в популация от клонирани хибридоми произвеждат моноклонални антитела от същия клас и подклас имуноглобулини. Моноклоналните антитела могат да бъдат модифицирани с помощта на техники за клетъчно имунно инженерство. По този начин е възможно да се получат "триоми" и "квадроми", произвеждащи моноклонални антитела с двойна определена специфичност, да се промени производството на пентамерен цитотоксичен IgM към производството на пентамерен нецитотоксичен IgM, мономерен нецитотоксичен IgM или IgM с намален афинитет , а също и за превключване (при запазване на антигенна специфичност) секрецията на IgM за секреция на IgD и секрецията на IgGl за секреция на IgG2a, IgG2b или IgA.
Геномът на мишката осигурява синтеза на повече от 1 * 10 7 различни варианта на антитела, които взаимодействат специфично с епитопи (антигенни детерминанти) на протеинови, въглехидратни или липидни антигени, присъстващи в клетките или микроорганизмите. Възможно е образуването на хиляди различни антитела към един антиген, различаващи се по специфичност и афинитет; например, имунизацията с хомогенни човешки клетки индуцира до 50 000 различни антитела. Използването на хибридоми дава възможност да се изберат практически всички варианти на моноклонални антитела, които могат да бъдат индуцирани срещу даден антиген в тялото на опитно животно.
Разнообразието от моноклонални антитела, получени срещу един и същ протеин (антиген), налага определянето на тяхната по-фина специфичност. Характеризирането и подбора на имуноглобулини с необходимите свойства сред многобройните типове моноклонални антитела, взаимодействащи с изследвания антиген, често се превръщат в по-трудоемка експериментална работа от получаването на моноклонални антитела. Тези изследвания включват разделяне на набор от антитела на групи, специфични за определени епитопи, последвано от селекция във всяка група на оптималния вариант по отношение на афинитет, стабилност и други параметри. За определяне на специфичността на епитопа най-често се използва методът на конкурентен ензимно-свързан имуносорбентен анализ.
Изчислено е, че първична последователност от 4 аминокиселини (типичен размер на епитопа) може да се появи до 15 пъти в аминокиселинната последователност на протеинова молекула. Въпреки това, кръстосаните реакции с моноклонални антитела се наблюдават с много по-ниска честота, отколкото би се очаквало въз основа на тези изчисления. Това се случва, защото не всички от тези региони се експресират на повърхността на протеиновата молекула и се разпознават от антитела. В допълнение, моноклоналните антитела откриват само аминокиселинни последователности в специфична конформация. Трябва също да се има предвид, че аминокиселинната последователност в протеиновата молекула не е разпределена средно статистически и местата на свързване на антитялото са много по-големи от минималния епитоп, съдържащ 4 аминокиселини.
Използването на моноклонални антитела разкри недостъпни досега възможности за изследване на механизмите на функционалната активност на имуноглобулините. За първи път, използвайки моноклонални антитела, беше възможно да се идентифицират антигенни разлики в протеините, които преди това са били серологично неразличими. Установени са нови разлики по подтип и щам между вируси и бактерии, открити са нови клетъчни антигени. С помощта на моноклонални антитела са открити антигенни връзки между структурите, чието съществуване не може да бъде надеждно доказано с поликлонални (конвенционални имунни) серуми. Използването на моноклонални антитела направи възможно идентифицирането на консервативни антигенни детерминанти на вируси и бактерии с широка групова специфичност, както и специфични за щама епитопи, които са силно променливи и разнообразни.
От основно значение е откриването на антигенни детерминанти с помощта на моноклонални антитела, които индуцират производството на защитни и неутрализиращи антитела срещу патогени на инфекциозни заболявания, което е важно за създаването на терапевтични и профилактични лекарства. Взаимодействието на моноклоналните антитела със съответните епитопи може да доведе до появата на пространствени (пространствени) пречки за проявата на функционалната активност на протеиновите молекули, както и до алостерични промени, които трансформират конформацията на активното място на молекулата и блокират. биологичната активност на протеина.
Само с помощта на моноклонални антитела беше възможно да се изследват механизмите на кооперативното действие на имуноглобулините, взаимното усилване или взаимното инхибиране на антитела, насочени към различни епитопи на един и същ протеин.
За производството на масови количества моноклонални антитела по-често се използват асцитни тумори на мишки. По-чисти препарати на моноклонални антитела могат да се получат върху среда без серум във ферментиращи суспензионни култури или в диализни системи, в микрокапсулирани култури и устройства като капилярни култури. За получаване на 1 g моноклонални антитела са необходими приблизително 0,5 L асцитна течност или 30 L културална течност, инкубирана във ферментатори със специфични хибридомни клетки. В производствена среда те произвеждат много големи количествамоноклонални антитела. Значителните разходи за производството на моноклонални антитела са оправдани от високата ефективност на пречистване на протеини върху имобилизирани моноклонални антитела, а коефициентът на пречистване на протеин в процедурата на едноетапна афинитетна хроматография достига няколко хиляди. Афинитетната хроматография на базата на моноклонални антитела се използва за пречистване на растежен хормон, инсулин, интерферони, интерлевкини, произведени от генетично модифицирани щамове на бактерии, дрожди или еукариотни клетки.
Използването на моноклонални антитела в диагностичните комплекти се развива бързо. До 1984 г. около 60 диагностични тестови системи, приготвени с помощта на моноклонални антитела, бяха препоръчани за клинични изпитвания в Съединените щати. Основното място сред тях заемат тест системи за ранна диагностика на бременността, определяне на съдържанието на хормони, витамини, лекарства в кръвта, лабораторна диагностика на инфекциозни заболявания.
Формулирани са критерии за избор на моноклонални антитела за тяхното използване като диагностични реагенти. Те включват висок афинитет към антигена, който осигурява свързване при ниска концентрация на антиген, както и ефективна конкуренция с антителата на гостоприемника, които вече са се свързали с антигените в тестовата проба; насочване срещу антигенен сайт, обикновено неразпознат от антителата на организма гостоприемник и следователно немаскиран от тези антитела; насочване срещу повтарящи се антигенни детерминанти на повърхностните структури на диагностицирания антиген; поливалентност, осигуряваща по-висока активност на IgM в сравнение с IgG.
Моноклоналните антитела могат да се използват като диагностични лекарства за определяне на хормони и лекарства, токсични съединения, маркери на злокачествени тумори, за класификация и броене на левкоцити, за по-точно и бързо определяне на кръвната група, за откриване на антигени на вируси, бактерии, протозои, за диагностика на автоимунни заболявания, откриване на автоантитела, ревматоидни фактори, определяне на класове имуноглобулини в кръвния серум.
Моноклоналните антитела позволяват успешно да се диференцират повърхностните структури на лимфоцитите и да се идентифицират с голяма точност основните субпопулации на лимфоцитите, да се класифицират клетките на човешка левкемия и лимфом в семейства. Нови реагенти на базата на моноклонални антитела улесняват определянето на В-лимфоцити и Т-лимфоцити, подкласове Т-лимфоцити, което го прави една от най-простите стъпки за изчисляване на кръвна формула. С помощта на моноклонални антитела една или друга субпопулация от лимфоцити може да бъде селективно отстранена, изключвайки съответната функция на клетъчната имунна система.
Обикновено диагностичните препарати на базата на моноклонални антитела съдържат имуноглобулини, белязани с радиоактивен йод, пероксидаза или друг ензим, използван в ензимните имуноанализи, както и флуорохроми, като флуоресцеин изотиоцианат, използван в имунофлуоресцентния метод. Високата специфичност на моноклоналните антитела е от особена стойност при създаването на подобрени диагностични препарати, повишаване на чувствителността и специфичността на радиоимунологичния, ензимен имуноанализ, имунофлуоресцентни методи за серологичен анализ и типизиране на антигени.
Терапевтичното използване на моноклонални антитела може да бъде ефективно, когато е необходимо да се неутрализират токсини от различен произход, както и антигенно активни отрови, да се постигне имуносупресия по време на трансплантация на органи, да се индуцира комплемент-зависима цитолиза на туморни клетки, да се коригира съставът на Т -лимфоцити и имунорегулация, за неутрализиране на бактерии, устойчиви на антибиотици, пасивна имунизация срещу патогенни вируси.
Основната пречка пред терапевтичното използване на моноклонални антитела е възможността за развитие на нежелани имунологични реакции, свързани с хетероложния произход на моноклоналните имуноглобулини. За да се преодолее това, е необходимо да се получат човешки моноклонални антитела. Успешните изследвания в тази насока правят възможно използването на моноклонални антитела като вектори за целево доставяне на ковалентно свързани лекарства.
Разработват се терапевтични лекарства, които са специфични за строго определени клетки и тъкани и имат насочена цитотоксичност. Това се постига чрез конюгиране на силно токсични протеини, например дифтериен токсин, с моноклонални антитела, които разпознават целевите клетки. Насочени от моноклонални антитела, химиотерапевтичните агенти са способни селективно да унищожават туморните клетки в тялото, които носят специфичен антиген. Моноклоналните антитела могат също да действат като вектор, когато се вмъкнат в повърхностните структури на липозомите, което осигурява доставянето на значителни количества лекарства, съдържащи се в липозомите, до целевите органи или клетки.
Последователното използване на моноклонални антитела не само ще увеличи информационното съдържание на конвенционалните серологични реакции, но също така ще подготви появата на принципно нови подходи за изследване на взаимодействието на антигени и антитела.
|
Изследвани параметри |
Видове антитела |
||
|
сенсибилизиране на кожата (реагини) |
блокиране |
хемаглутиниращ |
|
|
Принцип на откриване на антитела |
Реакции с алерген в кожата |
Блокиране на реакцията на алерген-реагин в кожата |
Реакция на индиректна хемаглутинация in vitro |
|
Стабилност при t ° 50 ° |
Термоустойчиви |
Термостабилен |
Термостабилен |
|
Способността за преминаване през плацентата |
Отсъстващ |
Няма данни |
|
|
Способността да се утаява с 30% амониев сулфат |
Да не се утаява |
Обсаден |
Частично се утаява, частично остава в разтвор |
|
Хроматография върху DEAE-целулоза |
Разпръснати в множество фракции |
В 1-ва фракция |
В 1-ва фракция |
|
Абсорбция от имуносорбенти |
Бавен |
Няма данни |
|
|
Утаяване на поленови алерген |
Не, дори след концентрация на антитела |
Да, след концентрация на антитела |
Преципитиращата активност не съвпада с хемаглутиниращата |
|
Инактивиране на меркаптан |
Се случва |
Няма да се случи |
Няма данни |
|
Разцепване от папаин |
Бавен |
Няма данни |
|
|
Константа на утаяване |
Повече от 7 (8-11) S |
||
|
Електрофоретични свойства |
Предимно γ1-глобулини |
γ2-глобулини |
По-голямата част от него е свързана с γ2-глобулини |
|
Имуноглобулинови клас |
|||
Библиография
Burnet F. Клетъчна имунология, транс. от английски, М., 1971; Гаурови с Ф. Имунохимия и биосинтеза на антитела, транс. от английски, М., 1969, библиогр.; Dosse J. Имунохематология, транс. от фр., М., 1959; Zdrodovsky PF Проблеми на инфекцията, имунитета и алергиите, М., 1969, библиогр.; Имунохимичен анализ, изд. L.A. Zilber, стр. 21, М., 1968; Кабот Е. и Майер М. Експериментална имунохимия, транс. от английски, М., 1968, библиогр.; Nezlin R.S. Структурата на биосинтеза на антитела. М., 1972, библиогр.; Nosse l G. Антитела и имунитет, транс. от английски, М., 1973, библиогр.; Петров Р.В. Форми на взаимодействие на генетично различни клетки на лимфоидната тъкан (триклетъчна система на имуногенеза), Усп. модерен биол., т. 69, с. 2, стр. 261, 1970; Утешев BS и Бабичев VA Инхибитори на биосинтеза на антитела. М., 1974; Ефроимсон В. П. Имуногенетика, М., 1971, библиогр.
Алергичен А.- Адо АД Алергия, Многотом. US Pat. физиол., изд. Х. Н. Сиротинина, т. 1, с. 374, М., 1966, библиогр.; Адо АД Обща алергология, с. 127, М., 1970; Polner A. A., Vermont I. E. и Serova T. I. Към въпроса за имунологичната природа на реагините при сенна хрема, в книгата: Probl. allergol., изд. A. D. Ado и A. A. Podkolzin, p. 157, М., 1971; Bloch K.J. Анафилактичните антитела на бозайници, включително човек, Progr. Алергия, v. 10, стр. 84, 1967, библиогр.; Ишизака К. а. Ishizaka T. Значението на имуноглобулин Е при реагинова свръхчувствителност, Ann. Алергия, v. 28, стр. 189, 1970, библиогр.; Лихтенщайн Л. М., Леви Д. А. а. Ishizaka K. In vitro обърната анафилаксия, характеристики на анти-IgE медиирано освобождаване на хистамин, Immunology, v. 19, стр. 831, 1970; Sehon A.H. Хетерогенност на антителата в алергични серуми, в: Molec. а. клетъчна основа за образуване на антитела, изд. от J. Sterzl, p. 227, Прага, 1965, библиогр.; Stanworth D. R. Имунохимични механизми на реакции на свръхчувствителност от незабавен тип, Clin. опит Immunol., W. 6, p. 1, 1970, библиогр.
Моноклонални антитела- Хибридоми: ново ниво на биологичен анализ, изд. Р. Г. Кенет и др., М., 1983; Рохлин О. В. Моноклонални антитела в биотехнологията и медицината, в книгата: Биотехнология, изд. А. А. Баева, с. 288, М., 1984; N о w i n s k i R. C. a. о. Моноклонални антитела за диагностика на инфекциозни заболявания при хора, Science, v. 219, стр. 637, 1983; Ollson L. Моноклонални антитела в клиничната имунобиология, Производство, потенциал и ограничения, Алергия, v. 38, стр. 145, 1983; Синко се бори с J. G. a. D r e s m a n G. R. Моноклонални антитела на хибридоми, Rev. заразявам. Дис., В. 5, стр. 9, 1983.
М. В. Земсков, Х. В. Журавлева, В. М. Земсков; А. А. Полнер (всички); А. К. Туманов (съд); A. S. Novokhatsky (Моноклонални антитела).
Алергичните антитела са голяма група от човешки и животински кръвни глобулини. Най-важната разлика между антителата и "нормалните" глобулини е тяхната имунологична специфичност и биологична способност да предизвикват определени алергични реакции.
Много имунни антитела имат свойствата на алергични антитела. Така например антитоксините към бактериалните екзотоксини участват в механизма на анафилактичния шок, причинен от тези токсини („токсинна анафилаксия“ според IV Morgunov, 1963 и др.), лизини и комплемент-свързващи антитела причиняват алергични реакции на „обратните тип "цитотоксичен" шок и различни алергични реакции на цитолиза (Forssman, 1911; Waksman, 1962).
Широка група алергични реакции се причиняват от антитела като преципитати и аглутинини; Феномен на Артус, феномен на Овери, анафилактичен шок при заек, серумна болест, лекарствена алергия (Artlius, 1903; Pirquet, 1907; Ovari, 1958). Сред антителата от тази група в механизма на алергичните реакции участват такива видове процитипи и аглутинини, които не са открити чрез обичайните методи за преципитация на пръстен, директна макро- и микроаглутинация и др. Тези антитела са открити в кръвта на хора със серумна болест или животни.с анафилактична сенсибилизация след отстраняване на преципитини от кръвта със специфичен антиген. След отстраняване на преципитините, кръвният серум запазва способността си да предава пасивно състоянието на обща или локална анафилаксия. Richefc (1907) и след това Friedberger (1909) наричат тези антитела анафилактични.
По-късно, при изучаване на редица форми на алергични заболявания (сенна хрема, „атопични“ заболявания, имунохематологични заболявания), бяха идентифицирани специални видове алергични антитела. Някои от тях показаха свойствата на преципитини или аглутинини само когато специални условияили специална техника за тяхното откриване (реакция на съпреципитация, аглутинация на еритроцити, предварително третирани с танин и др.). Тези алергични антитела са известни като "ienrecinating" ("непълни"), алергични студови аглутинини и др.
Тази група алергични антитела заема като че ли междинна позиция между пълноценните преципитации и аглутинини и група алергични антитела, които причиняват сенсибилизация на кожата на здрав човек след приложение, т.е. кръвния серум на пациент с полино ,
сом или друг вид непосредствена (химергична) алергия "тип (алергия към гъбични, прахови, хранителни и други алергени). Sosa (1925) нарича последния тип антитела" реагини ", или" атопипи "(фамилното име не приема корен). Биологични и физични -химичните свойства на реагините се различават значително от свойствата на всички известни имунни антитела.
Абсолютно уникални антитела, участващи в механизма на алергичните реакции от забавен тип и някои непосредствени алергични реакции, са така наречените тъканни, или клетъчни, фиксирани антитела. Свойствата и механизмът на действие на тези антитела все още не са достатъчно проучени. По този начин много видове антитела участват в механизмите на различни алергични реакции, вариращи от антитела с биологични и физикохимични свойства на имунната система до специални видове антитела, които нямат нищо общо с антитела, които причиняват имунни реакции.
Всички алергични антитела могат да бъдат разделени на две големи групи. Първата група включва антитела от кръв и други биологични течности (хуморални антитела), втората група включва антитела, които седят върху клетки - тъканни, фиксирани или "сосилни" (клетъчни антитела). Последната група антитела не трябва да се бърка с хуморалните антитела, които са вторично фиксирани върху гладкомускулните клетки, върху други тъкани с пасивна анафилаксия и незабавна алергия (реакция на Шулц-Дейл, пасивна кожна анафилаксия - феномен на Overy, пасивен анафилактичен шок и др. ).
Връзката между различните видове алергични антитела може да бъде представена като следната диаграма (Схема 7).
Схема 7
ВЗАИМОДЕЙСТВИЯ НА РАЗЛИЧНИ ВИДОВЕ АЛЕРГИЧНИ АНТИТЕЛА Алергични антитела
„Безплатно фиксирано (клетъчно)
П за д и п е н т е н е н е н е н т е н е н т е н е н т е н е т
Коджио-сеизбилизиращо блокиране (защитни антитела)
(реагин)
Биологичните и физикохимичните свойства на нормалните и имунните глобулини в кръвния серум на хора и животни са във фокуса на вниманието на съвременните биохимици и имунолози.
Поглед към антителата, включително алергичните, като променени кръвни глобулини, е разработен у нас от V. A. Barykin (1927), N. F. Gamaleya (1928) под формата на учението за имунитета като функция на колоидно състояние на кръвните протеини ( VA Barykip) или Лий под формата на теорията на отпечатъците (NF Gamaleya), по-късно разработена от Полинг и Хауровиц и много други имунолози.
Хуморалните алергични антитела, заедно с имунологичните антитела, представляват голямо семейство от глобулини, които са придобили способността да се свързват специфично с голямо разнообразие от алергени,
които са причинили тяхното формиране или имат общи детерминантни групи с тях. Според Grabar (1963) антителата, както имунни, така и алергични, изразяват от физиологична гледна точка транспортната функция на кръвните глобулини в същата степен, каквато е известна за преноса на въглехидрати (гликопротеини), липоиди (липопротеини) и други вещества чрез глобулини. Очевидно в случая на антитела тази транспортна функция едновременно получава висока степен на имунологична специфичност, осигуряваща на антителата техните защитни или агресивни ефекти.
Специфичността на някои алергични антитела е относителна. Когато зайците са сенсибилизирани с един вид растителен прашец, възникват антитела към много видове поленови алергени (AD Ldo et al., 1963). В клиниката на полипоза обикновено се наблюдава поливалентна чувствителност към много видове цветен прашец от дървета и треви. При серумна болест, ревматизъм се наблюдават антитела, които аглутинират и лизират овчи еритроцити (хетерофилни антитела на форсман), както и утаяване на кръвни протеини на много видове бозайници (зайци, котки, кучета, плъхове, мишки и др.).
Cooke и Sherman (1940) демонстрират възможността алергични антитела да реагират с много алергени в реакция на пасивно прехвърляне. Когато заек се имунизира с кръвния серум на овен, преципитипи се образуват и до протеини от кръвта на хора, коне и прасета (Landsteiner, van Sclicer, 1939, 1940).
Алергична реакциятой се различава от имунния отговор по увреждане на собствените тъкани. Възпаление с хиперергичен характер, оток, бронхоспазъм, сърбеж, цитотоксични и цитолитични ефекти, шок - всички тези клинични признаци на алергична реакция са израз на увреждане, причинено от имунния механизъм [Pytskiy VI et al., 1984]. Един от характерни чертиАлергичното заболяване е производството на алергични антитела. При изследването на алергичните заболявания (полинови, „атопични” заболявания, имунохематологични заболявания и др.) са открити няколко функционално различими алергични антитела. Връзката на различни видове алергични антитела според A.D. Ado (1970) е показана на Схема 1:
Според класификацията на AD Ado алергичните антитела се разделят на две групи: антитела от кръв и други биологични течности (хуморални антитела) и тъканни антитела (фиксирани, „силни“, клетъчни). Алергичните антитела, подобно на имунните антитела, принадлежат към имуноглобулините. Те имат свойството специфично да се свързват с алергени, които са причинили тяхното образуване, или да имат общи детерминантни групи с тях [Ado AD, 1970]. Има пет вида имуноглобулини, които се различават по физични и химични свойства: IgG, IgA, IgM, IgD, IgE.
Алергични антитела (реагини)основно принадлежат към петия тип имуноглобулини - IgE, но сред тях има и реагини от класа с коефициент на утаяване около 7. Смята се, че LgE се синтезират в лимфоидната тъкан на лигавиците и лимфните възли и следователно дихателните органи са шокови органи при реакция от реагинен тип, черва, конюнктива. Реагиозният тип реакция е в основата на атопичните заболявания (атопичен дерматит, сенна хрема, бронхиална астма и др.). Реагини или кожно-сенсибилизиращи антитела се намират в кръвния серум на пациенти с непосредствен тип свръхчувствителност и имат способността да сенсибилизират кожата, както и лигавицата на носа, очите и дихателните пътища, което се определя с помощта на алергологични тестове.
Появата на блокиращи антитела, открити в RPHA, се свързва със защитен фактор срещу увреждащия ефект на алергена. Ролята на блокирането на алергичните антитела обаче не е напълно разбрана. Преципитиращите алергични антитела участват в имунокомплексната патология, комплемент-свързващите - в различни видове алергични реакции (туберкулинови, анафилактични, полинози, екземи).
По правило в алергичния отговор участват не само В-, но и ефекторните Т-лимфоцити. Преобладаващото развитие на реакцията в една или друга посока се определя до голяма степен от дозата, химичната структура и физикохимичното състояние на антигена. В резултат на влиянието на алергена и междуклетъчните взаимодействия се активират лимфоцитите, което е придружено от резки биохимични промени. На първо място, те са регистрирани в клетъчната мембрана: повишава се пропускливостта им за много вещества, променя се активността на циклазите, които регулират нивото на цикличните нуклеотиди на цикличния аденозин монофосфат (cAMP) и цикличния гуанозин монофосфат (cGMP). Преобладаването на първия определя разпространението на процеса на клетъчно узряване, преобладаването на второто води до увеличаване на клетъчното делене. Регистрират се и множество биохимични промени в цитоплазмата, гранулите и клетъчното ядро. Процесът на активиране на лимфоцити със синтеза на ДНК в клетките е завършен, синтезът на РНК и протеин се засилва.
Ефекторните Т-лимфоцити (Т-килъри) отделят медиатори, които определят биологичния им ефект (например лимфотоксини). Значителни промени засягат техните мембрани: съдържанието на някои макромолекули на повърхността им се променя, някои маркери изчезват, други се появяват. Т-клетките убийци не губят рецептори за антигена: те се нуждаят от тях, за да разпознаят целевите клетки, върху които действат.
Сред клетъчните механизми на цитолиза, цитотоксичността, причинена от Т-клетките убийци на имунитета, е най-изучавана. Т-клетъчната цитолиза се състои от няколко етапа: установяване на контакт между убиеца и целевата клетка (тази фаза е обратима - клетъчното делене предотвратява смъртта на целевите клетки), програмиран лизис (целената клетка изглежда жизнеспособна, но е обречена на смърт) и завършването на лизиса. Целевите клетки, убити от един от тези механизми, след това се елиминират от макрофагите и други фагоцитни клетки.
- Механизмът на развитие на алергичните заболявания зависи от участието на различни алергични антитела и Т-ефекторни лимфоцити. AD Ado разделя всички алергични реакции на истински, или действително алергични, и фалшиви, или псевдоалергични (неимунологични). Вярно, или всъщност алергично, авторът разделя на химергични (В-зависими) и цитергични (Т-зависими). Най-разпространената в алергологията е класификацията на Gell-Coombs, според която трябва да се разграничат алергичните реакции:
- Тип I - анафилактичен, в който участват IgE и по-рядко IgG4 антитела;
- Тип II - цитотоксичен с участието на IgG и IgM антитела по време на адсорбцията на алергена върху целевите клетки;
- Тип III (тип Artyus) - увреждане от имунния комплекс с участието на IgG и IgM антитела;
- Тип IV - забавена свръхчувствителност, реализирана от Т-лимфоцити.
Механизмът на алергична реакция от забавен типсе състои в следното: при навлизане на алерген в тялото се образуват сенсибилизирани лимфоцити. Това са Т-популации от лимфоцити, които имат вградени в мембраната структури, които играят ролята на антитела и са способни да се свързват с антигена. Влизайки отново в тялото, алергенът се комбинира със сенсибилизирания лимфоцит, което води до активиране и пролиферация на клетките, повишен синтез на ДНК и РНК и секреция на лимфокинови медиатори. Някои лимфокини насърчават мобилизирането на различни клетки, други (с хемотактична активност) - активират хемотаксиса на макрофагите, полиморфонуклеарните клетки до местоположението на алергена. Под влияние на други медиатори те се задържат на това място и тяхната фагоцитна активност се увеличава. В допълнение, лимфокините имат цитотоксичен, клетъчно инхибиращ ефект. Убийствените лимфоцити могат да имат директен цитотоксичен ефект върху целевите клетки. На мястото, където лимфоцитът се съединява с адсорбирания от клетките алерген, настъпва разрушаването на тези клетки, последвано от фагоцитоза на клетъчните остатъци и пропускливостта на съдовете се увеличава, тоест картина на възпалителна реакция от продуктивен тип развива се.
Имунологичен стадий на свръхчувствителностзабавеният тип се характеризира с активиране на тимус-зависимата имунна система. Сенсибилизираните лимфоцити във фокуса на алергична реакция са 1-2%. Останалите нечувствителни клетки, привлечени от действието на лимфокини. Патохимичният стадий на алергична реакция тип IV се характеризира с освобождаване на медиатори - лимфокини в резултат на взаимодействието на Т- и В-лимфоцитите с алергени. Следните лимфокини са най-изучавани:
- 1. Фактор, който инхибира миграцията на макрофагите (MIF), допринасяйки за натрупването на макрофаги в зоната на алергична промяна, засилвайки тяхната активност и фагоцитоза.
- 2. Фактор, който стимулира образуването на ендогенни пирогени.
- 3. Митогенни фактори: лимфоцитен митогенен фактор (LMP), интерлевкин 1 от макрофагов произход и интерлевкин 2, секретиран от Т-хелпери.
- 4. Хемотактичен фактор, водещ до хемотаксис на съответните левкоцити (макрофаги, неутрофилни, базофилни и еозинофилни гранулоцити).
- 5. Лимфотоксини, причиняващи увреждане или разрушаване на различни целеви клетки.
- 6. Кожно-реактивен фактор, от който зависи тежестта на възпалението. Намаляването на освобождаването на кожен реактивен фактор от кръвните лимфоцити показва потискане на клетъчния имунитет.
- 7. Трансфер фактор, който предава "имунологичната памет" на сенсибилизиращия алерген.
Освен медиаторите на лимфоцитите и макрофагите, в увреждащия ефект участват лизозомни ензими, кинини и други системи.
Патофизиологичен стадий на алергична реакциязабавеното действие се характеризира с увреждащия ефект на сенсибилизираните лимфоцити върху целевата клетка. Цитотоксичният ефект на Т-лимфоцитите е възможен чрез лимфотоксин, индиректно, а също и поради освобождаването на лизозомни ензими в процеса на фагоцитоза.
Медиаторите на патохимичния стадий от тип IV алергична реакция образуват възпаление, което е, от една страна, защитен фактор, от друга страна, фактор на увреждане, дисфункция на органа, където се развива.
При алергични реакции от незабавен тип е необходимо наличието на хуморални антитела, които са протеини от типа и се свързват само със специфични антигени. Комплексът антиген-антитяло причинява различни увреждания в организма. Разтворимите антигени най-често причиняват утаяване; антигени под формата на еритроцити, бактерии, вируси, колоидни частици, когато се комбинират със специфични антитела - реакция на аглутинация. За откриване на антитела в имунологията се използват различни реакции.
Антителата се произвеждат от лимфоидни клетки на лимфните възли, далака, костния мозък, сливиците. Те могат да бъдат открити в кръвта 7-15 дни след инжектирането на алергена. Максималното ниво на антитела се наблюдава в кръвта в продължение на няколко седмици или повече, след което производството на антитела намалява и те могат да бъдат открити в кръвта в минимални количества в продължение на няколко месеца. Продължителността на живота на антителата, циркулиращи в кръвта, е 20 дни; това показва дългосрочен синтез на техните имунокомпетентни клетки.
Антителата се отнасят до серумни глобулини. Повечето новородени бозайници имат много малко глобулини – липсват им антитела. В рамките на няколко седмици след раждането се наблюдава повишаване на кръвните глобулини и успоредно с това повишаване на нивото на антителата.
При новородено бебе нивото на гама глобулините е близко до нормалното, но повечето от тези гама глобулини са майчини. Съдържанието на гама глобулини намалява през първите два месеца от живота, тъй като производството на глобулини е изключително слабо. Едва на третия месец от живота производството на гама глобулини достига определено ниво.
С помощта на метода на електрофореза е възможно да се отделят различни протеинови фракции на кръвния серум и да се определи към кои глобулинови фракции принадлежат антителата.
Така се установи, че антителата принадлежат към различни фракции на глобулините – от гама до алфа (това са имуноглобулини) (фиг. 5).
Ориз. 5. Имуноелектрофореза на нормален кръвен серум.
Антителата, които се образуват в организма при различни инфекции, ваксинации, в повечето случаи се отнасят до гама глобулини с молекулно тегло до 180 000. В първата фаза на производство на антитела се откриват макроглобулини с молекулно тегло до 900 000. Основно свойство на антителата е способността им да се свързват с антигени или по-точно с определени групи от техните молекули, което е причинило образуването на антитела. Химическата структура на тези антигенно специфични групи все още е неизвестна. Предполага се, че специфичността на антителата се определя от редица полипептиди или три до четири захарни молекули.
„Регионът“ на молекулата на антитялото, който играе роля в реакцията антиген-антитяло, е много малък. Съвременните имунологични методи на изследване (дифузия, електрофореза, ултрацентрофугиране) позволиха да се установи, че повечето имунни антитела имат две специфични „места“ на всяка молекула, чрез които антитялото се свързва със специфичен антиген – това са валентностите на антителата. Степента на привличане на антиген и антитяло се определя от електростатичните и междумолекулните сили, притежавани от макромолекулите, както и други: кулонови сили, сили на Ван дер Ваалс, както и водородни връзки и ковалентност. Всичко това определя характерната структура на протеиновата молекула.
Реакцията антиген-антитяло е много бърза. Смята се, че пълната комбинация от протеин и антипротеин се случва в рамките на няколко секунди при 0°C.
Образуването на комплекс антиген-антитяло се дължи на двойната валентност на антителата и поливалентността на антигените. Според Марак реакцията между двувалентни и поливалентни молекули води до образуване на съединение, чийто размер непрекъснато нараства с прикрепването на нови молекули – образуват се конгломерати, чийто брой хидрофилни групи намалява, като по този начин се образуват неразтворими утайки.
Реакцията на утаяване е много специфична и с помощта на много методи е възможно не само да се открият преципитиращи антитела в кръвния серум, но и да се определи тяхното ниво.
Механизмът на реакцията на аглутинация има много общо с механизма на реакцията на утаяване. Антигенът в тези реакции са бактерии, кръвни клетки и инертни частици, покрити с разтворим антиген отгоре. При тази реакция антителата се свързват с антигени на повърхността на клетките и частиците.

Ориз. 6. Схема на комплекса антиген-антитяло. A - зона на излишък от антиген; B - точка на еквивалентност; B - площта на излишните антитела.
Поради бивалентността на антителата всяка молекула на антитялото се комбинира с две антигенни частици, образувайки един вид мост между тях (фиг. 6), докато клетките или частиците са аглутинирани. Реакцията на аглутинация е строго специфична.
Има много методи за изследване на аглутинация, които могат да се използват за определяне на нивото на аглутиниращи антитела в кръвния серум. Тези реакции са много чувствителни и достатъчно точни. За серологични реакции се използва най-високото разреждане на имунния серум, който аглутинира с микробни тела или кръвни клетки, суспендирани във физиологичен разтвор. В имунологията се извършва индиректна реакция, като се използват нормални агнешки или човешки еритроцити, върху които е фиксиран антигенът. Еритроцитите могат да се поставят и върху инертни частици: латекс, колодий, политерон и др. Определете най-голямото разреждане на серума, което дава видима аглутинация. Различни модификации на реакцията на аглутинация позволяват откриването на антитела на много ниско ниво - до 0,005 μg азотен протеин на антитялото в 1 ml.
В развитието на алергични реакции от незабавен и забавен тип могат да се разграничат следните етапи (A.D. Ado):
- 1) етап на имунни отговори;
- 2) стадий на патохимични нарушения;
- 3) стадий на патофизиологични нарушения.
Етап на имунен отговор
Етапът на имунните реакции се характеризира с натрупване на антитела, специфични за даден алерген в организма. Начални етапиразвитието на алергична реактивност в много отношения наподобява развитието на имунитет (оттук и името "стадий на имунни реакции"), а именно, алергенът се фиксира в клетките на ретикулоендотелната система и причинява плазматизация на лимфоидните клетки. При последния започва образуването на антитела. Алергичните антитела, подобно на имунните антитела, имат висока степен на специфичност, тоест се свързват само с алергена, който е причинил тяхното образуване. Алергичните антитела се намират в глобулиновите фракции на серумните протеини. Мястото и механизмът на образуване на алергичните антитела не се различават фундаментално от тези за имунните антитела. Появата в организма на специфични алергични антитела определя състоянието на сенсибилизация, тоест появата на свръхчувствителност към някакъв алерген (от лат. sensibilis - чувствителен). Разграничаване на сенсибилизация активни и пасивни .
Активна сенсибилизация възниква при въвеждане на алергена в тялото на животното по парентерален път (интрамускулно, подкожно, в подложките на краката, в коремната кухина, в гръбначно-мозъчната течност, чрез вдишване и др.). За сенсибилизация е достатъчно много малко количество от алергена – от порядъка на стотни и хилядни от грама (фиг. 14). Състоянието на свръхчувствителност не се появява веднага след инжектирането на алергена, а след 10-14 дни, продължава при животните в продължение на 2 месеца или повече и след това постепенно изчезва. При хората сенсибилизацията може да продължи месеци и години.
В процеса на сенсибилизация се повишава фагоцитната активност на клетките на ретикулоендотелната система, започва плазматизацията на лимфоидните клетки и започва производството на антитела в тях.
Още от първите дни на сенсибилизация в стволовете на соматичните и вегетативните нерви се наблюдава повишаване на възбудимостта, функционална подвижност според Н. Е. Введенски и скъсяване на хронаксия. Рецептори вътрешни органии кръвоносните съдове претърпяват фазови промени, тяхната възбудимост отначало се увеличава, а след това се инхибира.
Пасивна сенсибилизация възниква, когато на здраво животно се инжектира серум на друго активно сенсибилизирано животно (за морско свинче, 5-10 ml, за заек, 15-20 ml). Състоянието на свръхчувствителност настъпва 18-24 часа след приложението на серума. Това време е необходимо, за да се фиксират антителата, съдържащи се в чуждия серум, в тъканите на тялото.
Органите, изолирани от тялото (черва, матка, бели дробове и др.), също могат да бъдат пасивно сенсибилизирани, като се поставят в среда с антитела; въвеждането на готови антитела в кожата предизвиква нейната локална пасивна сенсибилизация.
Свойства на алергичните антитела
Алергичните антитела са модифицирани кръвни глобулини. Най-важните им биологични свойства са:
- а) имунологична специфичност, тоест способността да се комбинира с алергена, който е причинил производството на тези антитела;
- б) способността, след комбиниране с алерген, да предизвиква определени алергични реакции.
Всички алергични антитела могат да бъдат разделени на две групи:
- 1) фиксирани (или клетъчни) антителатясно свързани с клетките и участващи в алергични реакции от забавен тип;
- 2) свободни (или циркулиращи) антителанамират се в кръвта и други телесни течности и причиняват незабавни алергични реакции.
Циркулиращи антитела разделена на утаяване и неутаяване ... Последните включват така наречените реагини, които блокират антителата, и някои други.
Преципитиращи антитела (IgG) се намират в кръвта при човешка серумна болест, анафилактичен шок при хора и животни, алергични възпаления при зайци (феномен Артус), алергични реакции към яйчен белтък, конски пърхот и някои други алергични реакции. Утайките са термично стабилни.
Реагини или сенсибилизиращи кожата антитела IgE се появява в кръвния серум на пациенти със сенна хрема или атонична бронхиална астма. Реагините не се откриват чрез конвенционални серологични реакции in vitro (утаяване, свързване на комплемента и т.н.), но те могат пасивно да сенсибилизират кожата на здрав човек и затова са наречени кожно-сенсибилизиращи антитела. Най-надеждният начин за откриване на реагините е реакцията на Prausnitz-Küstner (реакция на пасивна кожна сенсибилизация). Серум на алергичен пациент в обем 0,05-0,1 ml се прилага интрадермално на здрав човек. Ден по-късно на същото място се инжектира специално подбрана доза от алергена. При положителна реакция се появяват хиперемия, оток, сърбеж (фиг. 14).
Реагините са термолабилни, тяхната активност намалява значително след нагряване на серума до 56 ° за 2-4 часа. Най-важното биологично свойство на реагините е тяхната "биспецифичност", тоест способността да се комбинират, от една страна, с клетката на чувствително животно, а от друга - с антиген. Благодарение на фиксирането върху клетките се проявява увреждащата способност на реагините.
Фиксирани или клетъчни антитела участват в механизма на забавена алергия. Въз основа на факта, че забавената алергия може да се предаде на друго животно или човек само с помощта на клетки (лимфоцити) на сенсибилизирания организъм, се стигна до заключението, че антитялото, причиняващо забавена алергия, трябва да се съдържа в клетките. Понякога се нарича "трансферен фактор" на сенсибилизацията. Този фактор се освобождава от сенсибилизираната клетка (лимфоцити и други клетки) и навлиза в други клетки чрез течна тъканна среда. Въздействайки върху тях, той предизвиква състояние на сенсибилизация в тях, освобождава се отново от тях и сенсибилизира следните клетки. По този начин малко количество алерген може да сенсибилизира голям брой клетки. Естеството на трансферния фактор не е точно известно. Известни са само някои от свойствата му; при хората е устойчив на действието на РНКаза, ДНКаза, трипсин, способен е да преминава през диализната мембрана и има молекулно тегло около 10 000.
Етап на патохимични промени
Ако специфичен алерген се въведе отново в сенсибилизиран (т.е. съдържащ алергични антитела) организъм, тогава между антителата и алергена възниква физикохимична реакция и се образува макромолекулен комплекс алерген-антитяло. Закрепвайки се в тъканите, този комплекс предизвиква редица метаболитни промени. На първо място, количеството кислород, погълнат от тъканите, се променя, има фазов характер (първо увеличение, след това намаляване).
Под въздействието на комплекса алерген-антитело се активират тъканни и клетъчни протеолитични и липолитични ензими, което води до нарушаване на функциите на съответните клетки. Например, следствие от увреждане на мастоцитите на съединителната тъкан, кръвните левкоцити (особено базофили и неутрофили) е освобождаването на хистамин, серотонин и някои други биологично активни вещества от тях.
хистамин... При хора и животни хистаминът се намира в мастоцити на съединителната тъкан, кръвни базофили, в по-малка степен в неутрофилни левкоцити, тромбоцити, в гладка и набраздена мускулатура, чернодробни клетки, епител стомашно-чревния тракти т.н.
Участието на хистамина в механизма на алергията се изразява в това, че причинява спазъм на гладката мускулатура (например бронхиоли, матка, черва и др.) и повишава пропускливостта на кръвоносните капиляри, причинявайки оток, уртикария, петехии и др. В допълнение, хистаминът повишава хидрофилността на свободните влакна на съединителната тъкан, допринасяйки за свързването на водата в тъканите и появата на обширен оток като ангиоедем (фиг. 15).

Хистаминът участва в механизмите на алергичните реакции при хората, като сърбеж, уртикария и краткосрочни хипотези. Хипотензивните реакции като колапс (или шок) най-вероятно се дължат на участието на кинини (брадикинин), а персистиращият бронхоспазъм (при бронхиална астма) се дължи на действието върху бронхиалното дърво на така нареченото бавно реагиращо вещество.
Бавно реагираща алергична субстанция (MRS-A)... Това е вещество, подобно по химична структура на невраминова киселина или глюкозиди на тези киселини. Това вещество причинява бавно свиване на гладките мускулни органи, за разлика от бързото свиване, причинено от хистамин. MRS-A причинява спазъм на човешки бронхиоли, неговата активност не се потиска от антихистамини и протеолитични ензими. Мястото на образуване на MPC-A при алергични реакции са мастоцитите на съединителната тъкан. Предполага се, че това вещество е от голямо значение за появата на бронхоспазъм при бронхиална астма при хората.
Серотонин(5-хидрокситриптамин) - намира се в почти всички тъкани на тялото, но е особено изобилно в мастоцитите на съединителната тъкан, клетките на далака, тромбоцитите, аргентофилните и ентерохромафинните клетки на стомаха, панкреаса, в някои нервни клетки, особено в хипоталамуса.
Информацията за участието на серотонин в алергичните реакции е доста противоречива. При опити върху животни е установено, че при морски свинчета, котки, плъхове предизвиква бронхоспазъм. При плъхове и мишки серотонинът се освобождава от мастоцитите под въздействието на яйчен белтък, декстран и някои други вещества. Има остър оток на лицето, тестисите, лапите (анафилактоидна реакция).
При човешки алергични реакции серотонинът не е от съществено значение.
Брадикинин- полипептид, състоящ се от 9 лявовъртящи се аминокиселини (аргинил-пролил-пролил-глицил-фенилаланил-серил-пролил-фенилаланил-аргинин). Образува се от алфа-2-глобулин в кръвта под въздействието на протеолитични ензими. При анафилактичен шок протеолитичните ензими се активират в резултат на действието на комплекса алерген-антитяло върху клетъчни протеази, като калидин, каликреин.
Брадикининът участва в патогенезата на анафилактичния шок при хора и животни: разширява кръвоносните капиляри, повишава тяхната пропускливост, понижава тонуса на артериолите и причинява хипотония.
хепарин- кисел мукополизахарид, съдържа много гранули на мастоцитни клетки. Освобождаването на хепарин от мастоцитите и навлизането му в кръвния поток се наблюдава при кучета с анафилактичен и пептонен шок, както и при инжекции в кръвта на вещества, които предизвикват освобождаването на хистамин. Това забавя съсирването на кръвта при кучета. При други животни (зайци, морски свинчета, плъхове) съсирването на кръвта не се променя. Участието на хепарина в алергичните реакции при хора е малко проучено.
ацетилхолин- в свободно състояние, свързано с протеини на тъканите, се съдържа в почти всички органи. Той участва в механизма на алергичните реакции главно на онези органи и тъкани, където холинергичните реакции са пряко включени в нормалните физиологични процеси (например синаптичните връзки на вегетативните и централните нервна система, инервация на сърцето, червата и др.). В процеса на сенсибилизация активността на холинестеразата на тъканите и кръвта се променя, а с разрешителното въвеждане на алергена се засилва освобождаването на ацетилхолин от тъканите.
Етап на патофизиологични промени
Патофизиологичният стадий на алергичните реакции е крайният израз на онези имунни и патохимични процеси, които са протекли след въвеждането на специфичен алерген в сенсибилизирания организъм. Състои се от реакцията на клетки, тъкани, органи и тялото като цяло, увредени от алергена.
Алергично увреждане на отделни клетки добре проучени на примера на еритроцити, тромбоцити, кръвни левкоцити, клетки на съединителната тъкан - хистиоцити, мастоцити и т. н. Увреждането се простира до нервните и гладкомускулните клетки, сърдечния мускул и т.н.
Реакцията на всяка от увредените клетки се определя от нейните физиологични характеристики. И така, в нервната клетка има електрически потенциал на увреждане, в миофибрилите на гладката мускулатура - контрактура; еритроцитите се подлагат на хемолиза. Увреждането на левкоцитите се изразява в преразпределение на гликоген в протоплазмата, в лизис. Гранулираните клетки набъбват и изхвърлят гранулите си - настъпва клетъчна дегранулация. Последният процес е особено изразен в кръвните базофили и мастоцитите от рехава съединителна тъкан, чиито гранули са особено богати на различни биологично активни вещества, които медиират алергичните реакции (фиг. 16).

Алергично увреждане на тъкани и органи възниква в резултат на увреждане на клетките, които изграждат тази тъкан, от една страна, и в резултат на нарушение на нервната и хуморалната регулация на функциите на тези органи, от друга. Така че контрактурата на гладката мускулатура на малките бронхи води до бронхоспазъм и намаляване на лумена на дихателните пътища. Въпреки това, промяна във възбудимостта на дихателния център и сетивните нервни окончания на блуждаещия нерв, в стените на алвеолите (нарушение на рефлекса на Херинг-Бройер) и интензивна секреция на слуз, която запушва лумена на бронхиолите, и разширяване на капилярите около алвеолите и повишаване на пропускливостта на стените на капилярите.
Разширяването на кръвоносните съдове и повишаването на пропускливостта на капилярите, което води до изпотяване на течната част от кръвта в тъканта и причинява появата на уртикария, оток на Квинке, зависи както от ефекта на алергичните медиатори (хистамин, серотонин) върху съдове, както и при нарушения на периферната и централната регулация на съдовия тонус. Общият израз на патофизиологичната фаза на алергичните реакции е реакцията на организма като цяло, определени алергични заболявания или алергични синдроми.