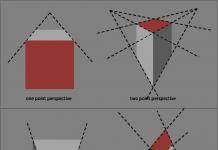
PROTILÁTKY- proteíny globulínovej frakcie krvného séra ľudí a teplokrvných živočíchov, ktoré sa tvoria v reakcii na zavedenie rôznych antigénov (baktérie, vírusy, proteínové toxíny atď.) do tela a špecificky interagujú s antigénmi, ktoré spôsobili ich tvorbu . Kontaktovaním aktívnych miest (centier) s baktériami alebo vírusmi protilátky bránia ich reprodukcii alebo neutralizujú toxické látky, ktoré uvoľňujú. Prítomnosť protilátok v krvi naznačuje, že telo interagovalo s antigénom proti ochoreniu, ktoré spôsobuje. O tom, do akej miery závisí imunita od protilátok a do akej miery protilátky len sprevádzajú imunitu, sa rozhoduje vo vzťahu ku konkrétnemu ochoreniu. Stanovenie hladiny protilátok v krvnom sére umožňuje posúdiť silu imunity aj v prípadoch, keď protilátky nehrajú rozhodujúcu ochrannú úlohu.
Ochranný účinok protilátok obsiahnutých v imunitných sérach je široko používaný v terapii a prevencii infekčných ochorení (pozri Séroprofylaxia, Séroterapia). Protilátkové reakcie s antigénmi (sérologické reakcie) sa využívajú pri diagnostike rôznych ochorení (pozri Sérologické testy).
História
Dlho o chemikálii. príroda A. vedel veľmi málo. Je známe, že protilátky po podaní antigénu sa nachádzajú v krvnom sére, lymfe, tkanivových extraktoch a že špecificky reagujú so svojim antigénom. Prítomnosť protilátok sa posudzovala na základe tých viditeľných agregátov, ktoré vznikajú pri interakcii s antigénom (aglutinácia, precipitácia) alebo zmenami vlastností antigénu (neutralizácia toxínu, lýza buniek), ale nebolo známe takmer nič. o chemickom substráte protilátok....
Použitím ultracentrifugácie, imunoelektroforézy a mobility proteínov v izoelektrickom poli bolo preukázané, že protilátky patria do triedy gamaglobulínov alebo imunoglobulínov.
Protilátky sú normálne globulíny vytvorené počas syntézy. Imunitné globulíny získané ako výsledok imunizácie rôznych zvierat rovnakým antigénom a počas imunizácie toho istého živočíšneho druhu rôznymi antigénmi majú rôzne vlastnosti, rovnako ako sérové globulíny rôznych živočíšnych druhov nie sú rovnaké.
Triedy imunoglobulínov
Imunoglobulíny sú produkované imunokompetentnými bunkami lymfoidných orgánov, líšia sa medzi sebou podľa móla. hmotnosť, sedimentačná konštanta, elektroforetická pohyblivosť, obsah sacharidov a imunologická aktivita. Existuje päť tried (alebo typov) imunoglobulínov:
Imunoglobulíny M (IgM): molekulová hmotnosť asi 1 milión, majú zložitú molekulu; prvé, ktoré sa objavia po imunizácii alebo antigénnej stimulácii, majú škodlivý účinok na mikróby, ktoré sa dostali do krvného obehu, prispievajú k ich fagocytóze; slabšie ako imunoglobulíny G, viažu rozpustné antigény, toxíny baktérií; sa v tele ničia 6-krát rýchlejšie ako imunoglobulíny G (napr. u potkanov je polčas imunoglobulínu M 18 hodín a imunoglobulínu G 6 dní).
Imunoglobulíny G (IgG): molekulová hmotnosť okolo 160 000, sú považované za štandardné, alebo klasické protilátky: ľahko prechádzajú cez placentu; sa tvoria pomalšie ako IgM; najúčinnejšie viaže rozpustné antigény, najmä exotoxíny a vírusy.
Imunoglobulíny A (IgA): molekulová hmotnosť asi 160 000 alebo viac, produkované lymfoidným tkanivom slizníc, zabraňujú degradácii enzýmov buniek tela a odolávajú patogénnemu pôsobeniu črevných mikróbov, ľahko prenikajú cez bunkové bariéry tela, sú obsiahnuté v kolostre , sliny, slzy, črevný hlien, pot, výtok z nosa, v krvi sú v menšom množstve, ľahko sa spájajú s bunkami tela; IgA zrejme vznikol v procese evolúcie na ochranu slizníc pred agresiou baktérií a prenosom pasívnej imunity na potomkov.
Imunoglobulíny E (IgE): molekulová hmotnosť asi 190 000 (podľa R.S. Nezlin, 1972); zrejme ide o alergické protilátky - takzvané reaginy (pozri nižšie).
Imunoglobulíny D (IgD): molekulová hmotnosť asi 180 000 (podľa R.S. Nezlin, 1972); v súčasnosti sa o nich vie veľmi málo.
Štruktúra protilátky
Molekula imunoglobulínu pozostáva z dvoch neidentických polypeptidových podjednotiek - ľahkých (L - z angl. light) reťazcov s molekulovou hmotnosťou 20 000 a dvoch ťažkých (H - z angl. heavy) reťazcov s molekulovou hmotnosťou 60 000. Tieto reťazce, spojené pomocou disulfidové mostíky, tvoria hlavný monomér LH. Takéto monoméry sa však nevyskytujú vo voľnom stave. Väčšina molekúl imunoglobulínu je zložená z dimérov (LH) 2, zvyšok sú polyméry (LH) 2n. Hlavnými N-terminálnymi aminokyselinami ľudského gamaglobulínu sú asparágová a glutámová, králičia - alanín a kyselina asparágová. Porter (RR Porter, 1959), pôsobiaci na imunoglobulíny s papaínom, zistil, že sa rozpadajú na dva (I a II) Fab-fragmenty a Fc-fragment (III) so sedimentačnou konštantou 3,5S a molekulovou hmotnosťou asi 50 000 sacharidy spojené s Fc-fragmentom. Na návrh odborníkov WHO bola stanovená nasledujúca nomenklatúra protilátkových fragmentov: Fab-fragment - monovalentný, aktívne sa viažuci na antigén; Fc-fragment - neinteraguje s antigénom a pozostáva z C-koncových polovíc ťažkých reťazcov; Fd fragment - oblasť ťažkého reťazca obsiahnutá vo Fab fragmente. Navrhlo sa, aby sa fragment peptickej hydrolýzy 5S označil ako F(ab)2 a monovalentný fragment 3,5S sa označil ako Fab.
Špecifickosť protilátky
Jeden z podstatné vlastnosti protilátky je ich špecifickosť, ktorá sa prejavuje v tom, že protilátky aktívnejšie a plnšie interagujú s antigénom, ktorým bolo telo stimulované. Komplex antigén-protilátka má v tomto prípade najväčšiu silu. Protilátky sú schopné rozlíšiť menšie štrukturálne zmeny v antigénoch. Pri použití konjugovaných antigénov, ktoré pozostávajú z proteínu a zahrnutej jednoduchej chemikálie, hapténu, sú výsledné protilátky špecifické pre haptén, proteín a komplex proteín-haptén. Špecifickosť je spôsobená chemickou štruktúrou a priestorovým vzorom antideterminantov protilátok (aktívne centrá, reaktívne skupiny), teda miestami protilátok, ktorými sa viažu na antigénne determinanty. Počet antideterminantných protilátok sa často označuje ako ich valencia. Takže molekula protilátky IgM môže mať až 10 valencií, molekuly protilátky IgG a IgA sú bivalentné.
Podľa Karasha (F. Karush, 1962) aktívne centrá IgG pozostávajú z 10-20 aminokyselinových zvyškov, čo je asi 1% všetkých aminokyselín molekuly protilátky, a podľa Winklera (MN Winkler, 1963) aktívne centrá pozostávajú z 3-4 aminokyselinových zvyškov. Obsahujú tyrozín, lyzín, tryptofán atď. Antideterminanty sa zrejme nachádzajú na amino-terminálnych poloviciach Fab-fragmentov. Na tvorbe aktívneho centra sa podieľajú variabilné segmenty ľahkých a ťažkých reťazcov, pričom hlavnú úlohu zohráva práve ten druhý. Je možné, že ľahký reťazec sa len čiastočne podieľa na tvorbe aktívneho centra alebo stabilizuje štruktúru ťažkých reťazcov. Najkompletnejší antideterminant vzniká len kombináciou ľahkých a ťažkých reťazcov. Čím viac bodov koincidencie vzťahu medzi anti-determinantami protilátok a determinantami antigénu, tým vyššia je špecificita. Rôzna špecificita závisí od sekvencie aminokyselinových zvyškov v aktívnom mieste protilátok. Kódovanie obrovského množstva protilátok z hľadiska ich špecifickosti je nejasné. Porter priznáva tri možnosti špecifickosti.
1. Tvorba stabilnej časti molekuly imunoglobulínu je riadená jedným génom a variabilná časť je riadená tisíckami génov. Syntetizované peptidové reťazce sa pod vplyvom špeciálneho bunkového faktora spoja do molekuly imunoglobulínu. Antigén v tomto prípade pôsobí ako faktor, ktorý spúšťa syntézu protilátok.
2. Molekula imunoglobulínu je kódovaná stabilnými a variabilnými génmi. V období bunkového delenia dochádza k rekombinácii variabilných génov, ktorá určuje ich diverzitu a variabilitu oblastí molekúl globulínu.
3. Gén kódujúci variabilnú časť molekuly imunoglobulínu je poškodený špeciálnym enzýmom. Iné enzýmy opravujú poškodenie, ale v dôsledku chýb umožňujú rôzne nukleotidové sekvencie v rámci daného génu. To je dôvodom rozdielnej sekvencie aminokyselín vo variabilnej časti molekuly imunoglobulínu. Existujú aj iné hypotézy, napr. Burnet (F. M. Burnet, 1971).
Heterogenita (heterogenita) protilátok sa prejavuje mnohými spôsobmi. V reakcii na zavedenie jedného antigénu sa vytvoria protilátky, ktoré sa líšia afinitou k antigénu, antigénnymi determinantami, molekulovou hmotnosťou, elektroforetickou pohyblivosťou, N-terminálnymi aminokyselinami. Skupinové protilátky proti rôznym mikróbom spôsobujú krížové reakcie na rôzne typy a typy Salmonella, Shigella, Escherichia, živočíšne bielkoviny, polysacharidy. Produkované protilátky sú heterogénne vo svojej špecifickosti pre homogénny antigén alebo jeden antigénny determinant. Heterogenita protilátok bola zaznamenaná nielen proti proteínovým a polysacharidovým antigénom, ale aj proti komplexným, vrátane konjugovaných antigénov a proti hapténom. Predpokladá sa, že heterogenita protilátky je určená známou mikroheterogenitou antigénnych determinantov. Heterogenita môže byť spôsobená tvorbou protilátok proti komplexu antigén-protilátka, čo sa pozoruje pri opakovanej imunizácii, rozdielom v bunkách, ktoré tvoria protilátky, ako aj príslušnosťou protilátok k rôznym triedam imunoglobulínov, ktoré podobne ako iné proteíny, napr. majú zložitú antigénnu štruktúru, riadenú geneticky.
Typy protilátok
Kompletné protilátky majú aspoň dve aktívne centrá a v kombinácii s antigénmi in vitro spôsobujú viditeľné reakcie: aglutináciu, precipitáciu, väzbu komplementu; neutralizujú toxíny, vírusy, opsonizujú baktérie, spôsobujú vizuálny fenomén imunitnej adhézie, imobilizácie, opuchu kapsuly, záťaže krvných doštičiek. Reakcie prebiehajú v dvoch fázach: špecifická (interakcia protilátky s antigénom) a nešpecifická (jeden alebo iný z vyššie uvedených javov). Všeobecne sa uznáva, že rôzne sérologické reakcie sú spôsobené skôr jednou protilátkou než viacerými protilátkami a závisia od spôsobu nastavenia. Rozlišujte medzi teplými kompletnými protilátkami, ktoré reagujú s antigénom pri t ° 37 °, a studenými (kryofilnými), ktoré vykazujú účinok pri t ° pod 37 °. Existujú tiež protilátky, ktoré reagujú s antigénom pri nízkych teplotách a viditeľný účinok sa prejavuje pri t ° 37 °; sú to dvojfázové, biotermálne protilátky, ku ktorým sú priradené Donat-Landsteinerove hemolyzíny. Všetky známe triedy imunoglobulínov obsahujú kompletné protilátky. Ich aktivita a špecifickosť sú určené titrom, aviditou (pozri Aviditet), počtom antideterminantov. IgM protilátky sú pri hemolýznych a aglutinačných reakciách aktívnejšie ako IgG protilátky.
Nekompletné protilátky(neprecipitujúce, blokujúce, aglutinoidy), podobne ako kompletné protilátky, sú schopné viazať sa na zodpovedajúce antigény, ale reakcia nie je sprevádzaná javom precipitácie, aglutinácie a pod., ktorý je viditeľný in vitro.
Nekompletné protilátky sa našli u ľudí v roku 1944 proti Rh antigénu, našli sa pri vírusových, rickettsiových a bakteriálnych infekciách vo vzťahu k toxínom pri rôznych patologických stavoch. Existujú určité dôkazy o bivalencii neúplných protilátok. Bakteriálne neúplné protilátky majú ochranné vlastnosti: antitoxické, opsonizačné, bakteriologické; zároveň sa pri rade autoimunitných procesov – pri ochoreniach krvi, najmä hemolytických anémiách – našli neúplné protilátky.
Nekompletné hetero-, izo- a autoprotilátky môžu spôsobiť poškodenie buniek a tiež zohrávajú úlohu pri výskyte leuko- a trombocytopénie vyvolanej liekmi
Predpokladá sa, že normálne (prirodzené) protilátky sa zvyčajne nachádzajú v sére zvierat a ľudí v neprítomnosti zjavnej infekcie alebo imunizácie. Pôvod normálnych antibakteriálnych protilátok môže súvisieť najmä s antigénnou stimuláciou normálnej mikroflóry tela. Tieto názory sú teoreticky a experimentálne podložené štúdiami na gnotobiontných zvieratách a novorodencoch za normálnych biotopových podmienok. Otázka funkcií normálnych protilátok priamo súvisí so špecifickosťou ich pôsobenia. LA Zilber (1958) veril, že individuálna odolnosť voči infekciám a navyše „imunogénna pripravenosť organizmu“ sú determinované ich prítomnosťou. Bola preukázaná úloha normálnych protilátok pri baktericídnej aktivite krvi, pri opsonizácii počas fagocytózy. Práca mnohých výskumníkov ukázala, že normálne protilátky sú najmä makroglobulíny – IgM. Niektorí vedci našli normálne protilátky v triedach IgA a IgG imunoglobulínov. Môžu obsahovať neúplné aj kompletné protilátky (normálne protilátky proti erytrocytom – pozri Krvné skupiny).
Syntéza protilátok
Syntéza protilátok prebieha v dvoch fázach. Prvá fáza je induktívna, latentná (1-4 dni), v ktorej sa protilátky a bunky produkujúce protilátky nezisťujú; druhá fáza je produktívna (začína po indukčnej fáze), protilátky sa nachádzajú v plazmatických bunkách a tekutine vytekajúcej z lymfoidných orgánov. Po prvej fáze tvorby protilátok začína veľmi rýchle tempo rastu protilátok, často sa ich obsah môže zdvojnásobiť každých 8 hodín a ešte rýchlejšie. Maximálna koncentrácia rôznych protilátok v krvnom sére po jednej imunizácii sa zaznamenáva 5., 7., 10. alebo 15. deň; po injekcii uložených antigénov - na 21.-30. alebo 45. deň. Potom, po 1-3 mesiacoch alebo viac, titre protilátok prudko klesnú. Niekedy však nízky level protilátky po imunizácii sa zaznamenávajú v krvi niekoľko rokov. Zistilo sa, že primárna imunizácia veľkým počtom rôznych antigénov je sprevádzaná objavením sa najprv ťažkých protilátok IgM (19S), potom na krátky čas protilátok IgM a IgG (7S) a nakoniec niektorých ľahkých protilátok 7S. protilátky. Opakovaná stimulácia senzibilizovaného organizmu antigénom urýchľuje tvorbu oboch tried protilátok, skracuje latentnú fázu tvorby protilátok, dobu syntézy protilátok 19S a podporuje prednostnú syntézu protilátok 7S. Často sa protilátky 19S vôbec neobjavia.
Výrazné rozdiely medzi indukčnou a produktívnou fázou tvorby protilátok sa nachádzajú pri štúdiu ich citlivosti na množstvo vplyvov, čo má zásadný význam pre pochopenie podstaty špecifickej profylaxie. Napríklad je známe, že ožarovanie pred imunizáciou oneskoruje alebo úplne inhibuje produkciu protilátok. Ožarovanie počas reprodukčnej fázy tvorby protilátok neovplyvňuje hladinu protilátok v krvi.
Izolácia a purifikácia protilátok
Na zlepšenie spôsobu izolácie a čistenia protilátok boli navrhnuté imunosorbenty. Metóda je založená na translácii rozpustných antigénov na nerozpustné antigény ich pripojením Kovalentné väzby na nerozpustnú bázu celulózy, Sephadexu alebo iného polyméru. Metóda umožňuje získať vysoko purifikované protilátky vo veľkých množstvách. Proces izolácie protilátok pomocou imunosorbentov zahŕňa tri fázy:
1) extrakcia protilátok z imunitného séra;
2) premytie imunosorbentu od nešpecifických proteínov;
3) odštiepenie protilátok z premytého imunosorbentu (zvyčajne tlmivé roztoky s nízkymi hodnotami pH). Okrem tohto spôsobu sú známe ďalšie spôsoby čistenia protilátok. Možno ich rozdeliť do dvoch skupín: špecifické a nešpecifické. Prvý je založený na disociácii protilátok z nerozpustného komplexu antigén-protilátka (precipitát, aglutinát). Vykonáva sa rôznymi látkami; rozšírená metóda enzymatického štiepenia antigénu alebo flokulátu toxínu - antitoxín amyláza, trypsín, pepsín. Používa sa aj tepelná elúcia pri t° 37-56°.
Nešpecifické metódy purifikácie protilátok sú založené na izolácii gama globulínov: gélová elektroforéza, chromatografia na iónomeničových živiciach, frakcionácia gélovou filtráciou cez Sephadex. Spôsob zrážania síranom sodným alebo amónnym je všeobecne známy. Tieto metódy sú užitočné v prípadoch vysokej koncentrácie protilátok v sére, ako je hyperimunizácia.
Gélová filtrácia cez Sephadexy, ako aj použitie iónomeničových živíc umožňujú oddeliť protilátky podľa veľkosti ich molekúl.
Použitie protilátok
Protilátky, najmä gamaglobulíny, sa používajú na liečbu a prevenciu záškrtu, osýpok, tetanu, plynatosti, antraxu, leptospirózy, proti stafylokokom, patogénom besnoty, chrípke a pod. Pri sérologickej identifikácii sa používajú špeciálne upravené a purifikované diagnostické séra. patogény (pozri . Identifikácia mikróbov). Zistilo sa, že pneumokoky, stafylokoky, salmonely, bakteriofágy atď. adsorbovaním zodpovedajúcich protilátok adherujú na krvné doštičky, erytrocyty a iné cudzie častice. Tento jav sa nazýva imunitná adhézia. Ukázalo sa, že v mechanizme tohto javu zohrávajú úlohu proteínové receptory krvných doštičiek a erytrocytov, ktoré sú zničené trypsínom, papaínom a formalínom. Imunitná adhézna odpoveď je závislá od teploty. Zohľadňuje sa adhéziou korpuskulárneho antigénu alebo hemaglutináciou spôsobenou rozpustným antigénom v prítomnosti protilátok a komplementu. Reakcia je vysoko citlivá a môže sa použiť na stanovenie komplementu aj veľmi malých (0,005-0,01 μg dusíka) množstiev protilátok. Imunitná adhézia zvyšuje fagocytózu leukocytmi.
Moderné teórie tvorby protilátok
Existujú poučné teórie tvorby protilátok, podľa ktorých sa narezaný antigén priamo alebo nepriamo podieľa na tvorbe špecifických imunoglobulínov, a teórie naznačujúce tvorbu geneticky už existujúcich protilátok proti všetkým možným antigénom alebo bunkám syntetizujúcim tieto protilátky. Patria sem selekčné teórie a teória represie – derepresie, ktorá umožňuje jednej bunke syntetizovať ľubovoľné protilátky. Navrhujú sa aj teórie, ktoré sa snažia pochopiť procesy imunologickej odpovede na úrovni celého organizmu, berúc do úvahy interakciu rôznych buniek a všeobecne akceptované predstavy o syntéze bielkovín v tele.
Gauwitz-Paulingova priama teória matice vychádza zo skutočnosti, že antigén po vstupe do buniek, ktoré produkujú protilátky, hrá úlohu matrice ovplyvňujúcej tvorbu molekuly imunoglobulínu z peptidových reťazcov, ktorých syntéza prebieha bez účasti antigénu. K „zásahu“ antigénu dochádza až v druhej fáze tvorby molekuly proteínu – fáze krútenia peptidových reťazcov. Antigén zmení koncové N-aminokyseliny budúcej protilátky (imunoglobulínu alebo jeho jednotlivých peptidových reťazcov) tak, že sa stanú komplementárnymi k antigénovým determinantom a ľahko sa s nimi naviažu. Takto vytvorené protilátky sa odštiepia od antigénu, dostanú sa do krvného obehu a uvoľnený antigén sa podieľa na tvorbe nových molekúl protilátky. Táto teória vyvolala množstvo vážnych námietok. Nedokáže vysvetliť vznik imunologickej tolerancie; vyššie množstvo protilátok produkovaných bunkou za jednotku času pre mnohonásobne menší počet molekúl antigénu, ktoré sú v nej dostupné; trvanie tvorby protilátok v organizme, počítané v rokoch alebo počas života, v porovnaní s oveľa kratším obdobím uchovávania antigénu v bunkách atď. fragmentov v bunkách syntetizujúcich protilátky nemožno úplne vylúčiť. Nedávno Gaurowitz (F. Haurowitz, 1965) navrhol nový koncept, podľa ktorého antigén mení nielen sekundárnu, ale aj primárnu štruktúru imunoglobulínu.
Nepriama Burnetova - Fennerova maticová teória slávu získal v roku 1949. Jeho autori sa domnievali, že makromolekuly antigénu a s najväčšou pravdepodobnosťou aj jeho determinanty prenikajú do jadier buniek zárodočného typu a spôsobujú v nich dedične fixované zmeny, ktorých výsledkom je tvorba protilátok proti tomuto antigénu. Pripúšťa sa analógia medzi opísaným procesom a transdukciou v baktériách. Nová kvalita tvorby imunoglobulínov získaná bunkami sa prenáša na potomstvo buniek v nespočetných generáciách. Otázka úlohy antigénu v opísanom procese sa však ukázala ako kontroverzná.
Táto okolnosť bola dôvodom vzniku teórie prirodzeného výberu Erne (K. Jerne, 1955).
Erneho teória prirodzeného výberu. Podľa tejto teórie antigén nie je matricou pre syntézu protilátok a nespôsobuje genetické zmeny v bunkách produkujúcich protilátky. Jeho úloha sa redukuje na selekciu dostupných „normálnych“ protilátok, ktoré spontánne vznikajú proti rôznym antigénom. Zdá sa, že sa to deje takto: antigén, ktorý vstúpil do tela, nájde zodpovedajúcu protilátku a spojí sa s ňou; výsledný komplex antigén-protilátka je absorbovaný bunkami, ktoré produkujú protilátky, a tie sú stimulované k produkcii protilátok práve tohto druhu.
Burnetova teória klonálnej selekcie (F. Burnet) bol ďalším vývojom Erneho myšlienky selekcie, ale nie protilátok, ale buniek, ktoré protilátky produkujú. Burnet sa domnieva, že v dôsledku všeobecného procesu diferenciácie v embryonálnom a postnatálnom období sa z mezenchymálnych buniek vytvorí mnoho klonov lymfoidných alebo imunologicky kompetentných buniek, schopných reagovať s rôznymi antigénmi alebo ich determinantami a produkovať protilátky - imunoglobulíny. Povaha odpovede lymfoidných buniek na antigén v embryonálnom a postnatálnom období je odlišná. Embryo buď globulíny neprodukuje vôbec, alebo ich syntetizuje málo. Predpokladá sa však, že tie z jej klonov buniek, ktoré sú schopné reagovať s antigénnymi determinantami vlastných proteínov, s nimi reagujú a v dôsledku tejto reakcie sú zničené. Je teda pravdepodobné, že bunky, ktoré tvoria anti-A-aglutiníny u ľudí s krvnou skupinou A a anti-B-aglutiníny u ľudí s krvnou skupinou B, odumrú. Ak sa do embrya vstrekne akýkoľvek antigén, podobne zničí zodpovedajúci klon. a novorodenec počas nasledujúceho života bude teoreticky tolerantný voči tomuto antigénu. Proces ničenia všetkých klonov buniek na vlastné proteíny embrya končí v čase jeho narodenia alebo uvoľnenia z vajíčka. Teraz má novorodenec len „svoje“ a rozpoznáva všetky „cudzie“, ktoré vstúpili do jeho tela. Burnet pripúšťa aj zachovanie „zakázaných“ klonov buniek schopných reagovať s autoantigénmi orgánov, ktoré boli izolované z buniek produkujúcich protilátky počas vývoja. Rozpoznanie „cudzích“ zabezpečujú zvyšné klony mezenchymálnych buniek, na povrchu ktorých sa nachádzajú zodpovedajúce antideterminanty (receptory, bunkové protilátky), komplementárne s determinantami „cudzieho“ antigénu. Povaha receptorov je daná geneticky, to znamená, že sú zakódované v chromozómoch a nie sú zavedené do bunky spolu s antigénom. Prítomnosť hotových receptorov nevyhnutne vedie k reakcii daného klonu buniek s daným antigénom, čo má teraz za následok dva procesy: tvorbu špecifických protilátok – imunoglobulínov a množenie buniek tohto klonu. Burnet pripúšťa, že mezenchymálna bunka, ktorá dostala antigénnu stimuláciu, vedie k vzniku populácie dcérskych buniek v poradí mitózy. Ak sa takáto bunka usadila v dreni lymfatickej uzliny, dáva podnet k tvorbe plazmatických buniek, pričom sa usadzuje v lymfatických folikuloch – lymfocytoch, v kostnej dreni – eozinofiloch. Dcérske bunky sú náchylné na somatické ireverzibilné mutácie. Keď sa vypočíta pre celý organizmus, počet mutujúcich buniek za deň môže byť 100 000 alebo 10 miliónov, a preto mutácie poskytnú bunkové klony pre akýkoľvek antigén. Burnetova teória vyvolala medzi výskumníkmi veľký záujem a veľké množstvo overovacích experimentov. Najdôležitejším potvrdením teórie bol dôkaz prítomnosti protilátkam podobných receptorov imunoglobulínovej povahy na prekurzoroch buniek produkujúcich protilátky (lymfocyty pôvodu z kostnej drene) a prítomnosť intercistrónového vylučovacieho mechanizmu v bunkách produkujúcich protilátky v r. vzťah k protilátkam rôznej špecificity.
Teóriu represie a derepresie formuluje Szilard(L. Szilard) v roku 1960. Podľa tejto teórie môže každá bunka, ktorá produkuje protilátku, potenciálne syntetizovať akúkoľvek protilátku proti akémukoľvek antigénu, ale tento proces je inhibovaný represorom enzýmu zapojeného do syntézy imunoglobulínu. Na druhej strane, tvorba represora môže byť inhibovaná vplyvom antigénu. Szilard verí, že tvorbu protilátok riadia špeciálne gény, ktoré zlyhávajú. Ich počet dosahuje 10 000 pre každú jednotlivú (haploidnú) sadu chromozómov.
Lederberg(J. Lederberg) sa domnieva, že v génoch zodpovedných za syntézu globulínov sú oblasti, ktoré riadia tvorbu aktívnych centier protilátok. Normálne je funkcia týchto miest inhibovaná, a preto prebieha syntéza normálnych globulínov. Pod vplyvom antigénu a prípadne aj pôsobením niektorých hormónov dochádza k dezinhibícii a stimulácii aktivity génových oblastí zodpovedných za tvorbu aktívnych centier protilátok a bunka začína syntetizovať imunoglobulíny.
Podľa H. N. Žukova-Verežnikova(1972), evolučnými prekurzormi protilátok boli ochranné enzýmy podobné tým, ktoré sa vyskytujú v baktériách so získanou rezistenciou na antibiotiká. Podobne ako protilátky, aj enzýmy pozostávajú z aktívnych (vo vzťahu k substrátu) a pasívnych častí molekuly. Mechanizmus „jeden enzým – jeden substrát“ bol pre svoju hospodárnosť nahradený mechanizmom „jednomolekuly s variabilnou časťou“, teda protilátky s variabilnou aktívne centrá... Informácie o produkcii protilátok sa realizujú v zóne „rezervných génov“, alebo v „zóne redundancie“ na DNA. Takáto redundancia môže byť zjavne lokalizovaná v jadrovej alebo plazmidovej DNA, ktorá uchováva „evolučnú informáciu..., ktorá zohrávala úlohu vnútorného mechanizmu, ktorý“ zhruba „kontroluje dedičnú variabilitu“. Táto hypotéza obsahuje poučnú zložku, ale nie je celkom poučná.
P.F.Zdrodovsky priraďuje antigénu úlohu derepresora určitých génov, ktoré riadia syntézu komplementárnych protilátok. Antigén zároveň, ako pripúšťa Zdrodovsky v súlade so Selyeho teóriou, dráždi adenohypofýzu, čo má za následok produkciu somatotropných (STH) a adrenokortikotropných (ACTH) hormónov. STH stimuluje plazmocytárne a protilátkotvorné reakcie lymfoidných orgánov, ktoré sú naopak stimulované antigénom, a ACTH pôsobiaci na kôru nadobličiek spôsobuje jej uvoľňovanie kortizónu. Ten v imunitnom tele inhibuje plazmocytickú reakciu lymfoidných orgánov a syntézu protilátok bunkami. Všetky tieto ustanovenia boli experimentálne potvrdené.
Pôsobenie systému hypofýza-nadobličky na tvorbu protilátok možno zistiť len u predtým imunizovaného organizmu. Je to tento systém, ktorý organizuje anamnestické sérologické reakcie v reakcii na zavedenie rôznych nešpecifických dráždivých látok do tela.
Hĺbkové štúdium bunkových zmien v procese imunologickej odpovede a akumulácia veľkého množstva nových faktov potvrdili názor, že imunologická odpoveď sa uskutočňuje len ako výsledok kooperatívnej interakcie určitých buniek. V súlade s tým bolo navrhnutých niekoľko hypotéz.
1. Teória spolupráce dvoch buniek. Zhromaždilo sa veľa faktov, ktoré naznačujú, že imunologická odpoveď v tele sa uskutočňuje v podmienkach interakcie rôznych typov buniek. Existujú dôkazy, že makrofágy sú prvé, ktoré asimilujú a modifikujú antigén, ale následne „inštruujú“ lymfoidné bunky, aby syntetizovali protilátky. Zároveň sa ukázalo, že existuje spolupráca medzi lymfocytmi patriacimi do rôznych subpopulácií: medzi T-lymfocytmi (závislé na týmuse, antine-reaktívne, pochádzajúce z týmusu) a B-bunkami (nezávislé na týmuse, prekurzory protilátok -tvoriace bunky, lymfocyty kostnej drene).
2. Teórie spolupráce troch buniek. Podľa názorov Roitta (I. Roitt) a iných (1969) je antigén zachytený a spracovaný makrofágmi. Tento antigén stimuluje antigén-reaktívne lymfocyty, ktoré prechádzajú transformáciou na blastoidné bunky, poskytujúce hypersenzitivitu oneskoreného typu a transformujú sa na dlhoveké bunky imunologickej pamäte. Tieto bunky vstupujú do spolupráce s progenitorovými bunkami produkujúcimi protilátky, ktoré sa následne diferencujú a proliferujú na bunky produkujúce protilátky. Väčšina antigénov má podľa Richtera (M. Richter, 1969) slabú afinitu k protilátkotvorným bunkám, preto je pre tvorbu protilátok potrebná nasledujúca interakcia procesov: antigén + makrofág - spracovaný antigén + bunka reaktívna na antigén - aktivovaný antigén + prekurzor buniek tvoriacich protilátky - protilátky. V prípade vysokej afinity antigénu bude proces vyzerať takto: antigén + prekurzor buniek tvoriacich protilátku - protilátky. Predpokladá sa, že za podmienok opakovanej stimulácie antigénom prichádza tento priamo do kontaktu s bunkou tvoriacou protilátku alebo bunkou imunologickej pamäte. Táto poloha je potvrdená väčšou rádiorezistenciou opakovanej imunologickej odpovede ako primárnej, čo sa vysvetľuje odlišnou rezistenciou buniek zapojených do imunologickej odpovede. Postulujúc potrebu trojbunkovej spolupráce v antitelogenéze, RV Petrov (1969, 1970) sa domnieva, že k syntéze protilátok dôjde iba vtedy, ak kmeňová bunka (prekurzor bunky tvoriacej protilátky) súčasne dostane spracovaný antigén z makrofágu, a induktor imunopoézy z antigén-reaktívnej bunky, vytvorený po jej (antigén-reaktívnej bunke) stimulácii antigénom. Ak sa kmeňová bunka dostane do kontaktu iba s antigénom spracovaným makrofágom, potom sa vytvorí imunologická tolerancia (pozri Imunologická tolerancia). Ak dôjde ku kontaktu kmeňovej bunky iba s bunkou reaktívnou na antigén, dochádza k syntéze nešpecifického imunoglobulínu. Predpokladá sa, že tieto mechanizmy sú základom inaktivácie nesyngénnych kmeňových buniek lymfocytmi, keďže induktor imunopoézy vstupujúci do alogénnej kmeňovej bunky je pre ňu antimetabolitom (syngénne – bunky s identickým genómom, alogénne – bunky toho istého typu, ale s iným genetickým zložením) ...
Alergické protilátky
Alergické protilátky sú špecifické imunoglobulíny tvorené alergénmi u ľudí a zvierat. Týka sa to protilátok cirkulujúcich v krvi v prípade alergických reakcií okamžitého typu. Existujú tri hlavné typy alergických protilátok: senzibilizujúce kožu alebo reaginy; blokovanie a hemaglutinácia. Biologické, chemické a fyzikálno-chemické vlastnosti ľudských alergických protilátok sú zvláštne ( tabl.).
Tieto vlastnosti sa výrazne líšia od vlastností precipitačných, komplement viažucich protilátok, aglutinínov a iných opísaných v imunológii.
Reaginy sa bežne používajú na označenie homológnych ľudských protilátok senzibilizujúcich kožu. Ide o najvýznamnejší typ ľudských alergických protilátok, ktorých hlavnou vlastnosťou je schopnosť uskutočniť reakciu pasívneho prenosu precitlivenosti na kožu zdravého príjemcu (pozri Prausnitzova-Küstnerova reakcia). Reaginy majú množstvo charakteristických vlastností, ktoré ich odlišujú od relatívne dobre preštudovaných imunitných protilátok. Mnohé otázky týkajúce sa vlastností reaginov a ich imunologickej povahy však zostávajú nevyriešené. Nevyriešená je najmä otázka homogenity alebo heterogenity reaginov v zmysle ich príslušnosti k určitej triede imunoglobulínov.
Blokujúce protilátky vznikajú u pacientov s polinózou v procese špecifickej hyposenzibilizačnej terapie na antigén, ktorým sa hyposenzibilizácia vykonáva. Vlastnosti tohto typu protilátok sa podobajú vlastnostiam precipitujúcich protilátok.
Pod hemaglutinačnými protilátkami sa zvyčajne rozumejú ľudské a zvieracie sérové protilátky schopné špecificky aglutinovať erytrocyty spojené s peľovým alergénom (nepriama alebo pasívna hemaglutinačná reakcia). Väzba povrchu erytrocytov s peľovým alergénom sa dosahuje rôznymi metódami, napríklad použitím tanínu, formalínu, dvojito diazotovaného benzidínu. U ľudí so zvýšenou citlivosťou na peľ rastlín je možné zistiť hemaglutinačné protilátky pred aj po špecifickej hyposenzibilizačnej terapii. V priebehu tejto terapie dochádza k transformácii negatívnych reakcií na pozitívne alebo k zvýšeniu titrov hemaglutinačnej reakcie. Hemaglutinujúce protilátky majú schopnosť pomerne rýchlo sa adsorbovať na erytrocytoch ošetrených peľovým alergénom, najmä niektorými jeho frakciami. Imunosorbenty odstraňujú hemaglutinujúce protilátky rýchlejšie, ako sa znovu vytvárajú. Hemaglutinačná aktivita je do určitej miery spojená s protilátkami senzibilizujúcimi kožu, ale úloha protilátok senzibilizujúcich kožu pri hemaglutinácii sa zdá byť nevýznamná, pretože neexistuje žiadna korelácia medzi protilátkami senzibilizujúcimi kožu a hemaglutinačnými protilátkami. Na druhej strane existuje korelácia medzi hemaglutinačnými a blokujúcimi protilátkami ako u jedincov s alergiou na peľ rastlín, tak aj u zdravých jedincov imunizovaných rastlinným peľom. Tieto dva typy protilátok majú mnoho rovnakých vlastností. V procese špecifickej hyposenzibilizačnej terapie sa zvyšuje hladina jedného aj druhého typu protilátok. Hemaglutinujúce protilátky proti penicilínu nie sú totožné s protilátkami senzibilizujúcimi kožu. Hlavným dôvodom vzniku hemaglutinačných protilátok bola liečba penicilínom. Zdá sa, že hemaglutinačné protilátky by sa mali zaradiť do skupiny protilátok, ktoré niektorí autori označujú ako „protilátky svedkov“.
V roku 1962 W. Shelley navrhol špeciálny diagnostický test založený na takzvanej degranulácii bazofilných leukocytov králičej krvi pôsobením alergénovej reakcie so špecifickými protilátkami. Povaha protilátok, ktoré sa zúčastňujú tejto reakcie, a ich vzťah s cirkulujúcimi reaginami však nie sú dobre známe, hoci existujú údaje o korelácii tohto typu protilátok s hladinou reaginov u pacientov so sennou nádchou.
Stanovenie optimálnych pomerov alergénu a testovacieho séra je z praktického hľadiska mimoriadne dôležité, najmä v štúdiách s typmi alergénov, o ktorých zatiaľ nie sú informácie v príslušnej literatúre.
Alergické protilátky zvierat zahŕňajú nasledujúce typy protilátok: 1) protilátky pri experimentálnej anafylaxii; 2) protilátky na spontánne alergické ochorenia zvierat; 3) protilátky, ktoré hrajú úlohu vo vývoji Arthusovej reakcie (precipitačný typ). Pri experimentálnej anafylaxii sa v krvi zvierat nachádzajú všeobecné aj lokálne, špeciálne typy anafylaktických protilátok, ktoré majú vlastnosť pasívne senzibilizovať kožu zvierat rovnakého druhu.
Ukázalo sa, že anafylaktická senzibilizácia morčiat na alergény peľu timotejky je sprevádzaná cirkuláciou kožných senzibilizačných protilátok v krvi.Tieto kožné senzibilizačné telieska majú tú vlastnosť, že vykonávajú homológnu pasívnu kožnú senzibilizáciu in vivo. Spolu s týmito homológnymi protilátkami senzibilizujúcimi kožu počas všeobecnej senzibilizácie morčiat na alergény peľu timotejky cirkulujú v krvi protilátky, ktoré sa detegujú pasívnou hemaglutinačnou reakciou s bis-diazotizovaným benzidínom. Protilátky senzibilizujúce kožu, ktoré vykonávajú homológny pasívny prenos a majú pozitívnu koreláciu s indexom anafylaxie, sa zaraďujú do skupiny homológnych anafylaktických protilátok alebo homocytotropných protilátok. Použitím termínu „anafylaktické protilátky“ im autori pripisujú vedúcu úlohu v reakcii anafylaxie. Začali sa objavovať štúdie potvrdzujúce existenciu homocyotropných protilátok proti proteínovým antigénom a konjugátom u rôznych typov pokusných zvierat. Viacero autorov rozlišuje tri typy protilátok podieľajúcich sa na alergických reakciách okamžitého typu. Sú to protilátky spojené s novým typom imunoglobulínov (IgE) u ľudí a podobné protilátky u opíc, psov, králikov, potkanov, myší. Druhým typom protilátok sú protilátky typu morčiat, ktoré môžu byť fixované na žírne bunky a izologické tkanivá. Líšia sa množstvom vlastností, najmä sú tepelne stabilnejšie. Predpokladá sa, že protilátky typu IgG môžu byť druhým typom anafylaktických protilátok u ľudí. Tretím typom sú protilátky, ktoré senzibilizujú heterológne tkanivá, patriace napríklad u morčiat do triedy y2. U ľudí majú schopnosť senzibilizovať kožu morčiat len protilátky typu IgG.
Pri ochoreniach zvierat sú popisované alergické protilátky, ktoré vznikajú pri spontánnych alergických reakciách. Tieto protilátky sú termolabilné a majú kožné senzibilizačné vlastnosti.
Neúplné protilátky vo forenznej vede sa používajú pri určovaní antigénov množstva izoserologických systémov (pozri Krvné skupiny) na zistenie príslušnosti krvi konkrétnej osobe v prípadoch trestných činov (vraždy, sexuálne trestné činy, dopravné nehody, ublíženie na zdraví, atď.). atď.), ako aj pri skúmaní sporného otcovstva a materstva. Na rozdiel od kompletných protilátok neaglutinujú červené krvinky vo fyziologickom roztoku. Medzi nimi sa rozlišujú protilátky dvoch typov. Prvým z nich sú aglutinoidy. Tieto protilátky sú schopné spôsobiť adhéziu červených krviniek v proteínovom alebo makromolekulárnom prostredí. Druhým typom protilátok sú kryptaglutinoidy, ktoré reagujú v nepriamom Coombsovom teste s antigamaglobulínovým sérom.
Na prácu s nekompletnými protilátkami bolo navrhnutých množstvo metód, ktoré sú rozdelené do troch hlavných skupín.
1. Metódy konglutinácie. Je potrebné poznamenať, že neúplné protilátky sú schopné spôsobiť aglutináciu erytrocytov v proteínovom alebo makromolekulárnom prostredí. Ako také médiá sa používajú krvné sérum skupiny AB (neobsahujúce protilátky), hovädzí albumín, dextrán, biogél - najmä purifikovaná želatína, upravená na neutrálne pH tlmivým roztokom a pod. (viď.Konglutinácia).
2. Enzymatické metódy. Nekompletné protilátky môžu spôsobiť aglutináciu erytrocytov, ktoré boli predtým liečené niektorými enzýmami. Na takéto spracovanie sa používa trypsín, ficín, papaín, výťažky z chlebových kvasníc, protelín, bromelín atď.
3. Coombsov test s antiglobulínovým sérom (pozri Coombsova reakcia).
Nekompletné protilátky súvisiace s aglutinoidmi môžu uplatniť svoj účinok vo všetkých troch skupinách metód. Protilátky súvisiace s kryptaglutinoidmi nie sú schopné aglutinovať erytrocyty nielen vo fyziologickom roztoku, ale ani v makromolekulárnom médiu a tiež ich v ňom blokovať. Tieto protilátky sa otvárajú až v nepriamom Coombsovom teste, pomocou ktorého sa objavia nielen protilátky súvisiace s kryptaglutinoidmi, ale aj protilátky, ktoré sú aglutinoidmi.
Monoklonálne protilátky
Z doplnkových materiálov, zväzok 29
Klasickým spôsobom výroby protilátok na diagnostické a výskumné účely je imunizácia zvierat určitými antigénmi a následné získanie imúnnych sér obsahujúcich protilátky požadovanej špecifickosti. Tento spôsob má množstvo nevýhod spojených predovšetkým so skutočnosťou, že imunitné séra zahŕňajú heterogénne a heterogénne populácie protilátok, ktoré sa líšia aktivitou, afinitou (afinitou k antigénu) a biologickým účinkom. Bežné imunitné séra obsahujú zmes protilátok špecifických pre daný antigén a molekuly proteínu, ktoré ho kontaminujú. Novým typom imunologických činidiel sú monoklonálne protilátky získané pomocou klonov hybridných buniek – hybridómov (pozri). Nepochybnou výhodou monoklonálnych protilátok je ich geneticky predurčený štandard, neobmedzená reprodukovateľnosť, vysoká citlivosť a špecifickosť. Prvé hybridómy boli izolované začiatkom 70-tych rokov 20. storočia, avšak skutočný rozvoj efektívnej technológie na vytváranie monoklonálnych protilátok je spojený so štúdiami G. Kohlera a S. Milsteina, ktorých výsledky boli publikované v roku 1975- 1976. V nasledujúcom desaťročí sa ďalej rozvíjal nový smer bunkového inžinierstva spojený s produkciou monoklonálnych protilátok.
Hybridómy sa tvoria, keď sa lymfocyty hyperimunizovaných zvierat spoja s bunkami transplantovanými plazmocytmi rôzneho pôvodu. Hybridómy dedia od jedného z rodičov schopnosť produkovať špecifické imunoglobulíny a od druhého schopnosť neobmedzeného množenia. Klonované populácie hybridných buniek môžu dlhodobo produkovať geneticky homogénne imunoglobulíny danej špecifickosti – monoklonálne protilátky. Najrozšírenejšie monoklonálne protilátky produkované hybridómami získanými pomocou unikátnej myšacej bunkovej línie MORS 21 (R3).
Neriešiteľné problémy technológie monoklonálnych protilátok zahŕňajú zložitosť a pracnosť získania stabilných, vysoko produktívnych hybridných klonov, ktoré produkujú monošpecifické imunoglobulíny; ťažkosti pri získavaní hybridómov produkujúcich monoklonálne protilátky proti slabým antigénom, ktoré nie sú schopné vyvolať tvorbu stimulovaných B-lymfocytov v dostatočnom počte; absencia určitých vlastností imunitných sér v monoklonálnych protilátkach, napríklad schopnosť tvoriť precipitáty s komplexmi iných protilátok a antigénov, na ktorých je založených mnoho diagnostických testovacích systémov; nízka frekvencia fúzie lymfocytov produkujúcich protilátky s myelómovými bunkami a obmedzená stabilita hybridómov v masových kultúrach; nízka stabilita počas skladovania a zvýšená citlivosť prípravkov monoklonálnych protilátok na zmeny pH, inkubačnej teploty, ako aj na zmrazenie, rozmrazovanie a vystavenie chemickým faktorom; ťažkosti pri získavaní hybridómov alebo transplantovateľných producentov ľudských monoklonálnych protilátok.
Takmer všetky bunky v populácii klonovaných hybridómov produkujú monoklonálne protilátky rovnakej triedy a podtriedy imunoglobulínov. Monoklonálne protilátky môžu byť modifikované použitím techník bunkového imunitného inžinierstva. Takto je možné získať „triómy“ a „kvadromy“ produkujúce monoklonálne protilátky s duálnou špecifikovanou špecifickosťou, zmeniť produkciu pentamérnych cytotoxických IgM na produkciu pentamérnych necytotoxických IgM, monomérnych necytotoxických IgM alebo IgM so zníženou afinitou. a tiež zmeniť (pri zachovaní antigénnej špecificity) sekréciu IgM na sekréciu IgD a sekréciu IgGl na sekréciu IgG2a, IgG2b alebo IgA.
Myší genóm poskytuje syntézu viac ako 1 * 107 rôznych variantov protilátok, ktoré špecificky interagujú s epitopmi (antigénnymi determinantami) proteínových, sacharidových alebo lipidových antigénov prítomných v bunkách alebo mikroorganizmoch. Je možná tvorba tisícok rôznych protilátok proti jednému antigénu, ktoré sa líšia špecifickosťou a afinitou; napríklad imunizácia homogénnymi ľudskými bunkami indukuje až 50 000 rôznych protilátok. Použitie hybridómov umožňuje vybrať prakticky všetky varianty monoklonálnych protilátok, ktoré je možné vyvolať proti danému antigénu v tele pokusného zvieraťa.
Rozmanitosť monoklonálnych protilátok získaných proti rovnakému proteínu (antigénu) si vyžaduje stanovenie ich jemnejšej špecifickosti. Charakterizácia a výber imunoglobulínov s požadovanými vlastnosťami spomedzi početných typov monoklonálnych protilátok interagujúcich so skúmaným antigénom sa často mení na prácnejšiu experimentálnu prácu ako získavanie monoklonálnych protilátok. Tieto štúdie zahŕňajú rozdelenie súboru protilátok do skupín špecifických pre určité epitopy s následnou selekciou v každej skupine optimálneho variantu z hľadiska afinity, stability a iných parametrov. Na stanovenie epitopovej špecificity sa najčastejšie používa metóda kompetitívneho enzýmového imunoanalýzy.
Odhaduje sa, že primárna sekvencia 4 aminokyselín (typická veľkosť epitopu) sa môže vyskytovať až 15-krát v aminokyselinovej sekvencii proteínovej molekuly. Krížové reakcie s monoklonálnymi protilátkami sú však pozorované s oveľa nižšou frekvenciou, než by sa na základe týchto výpočtov očakávalo. Stáva sa to preto, že nie všetky tieto oblasti sú exprimované na povrchu proteínovej molekuly a sú rozpoznávané protilátkami. Okrem toho monoklonálne protilátky detegujú len aminokyselinové sekvencie v špecifickej konformácii. Malo by sa tiež vziať do úvahy, že aminokyselinová sekvencia v molekule proteínu nie je štatisticky distribuovaná v priemere a väzbové miesta protilátky sú oveľa väčšie ako minimálny epitop obsahujúci 4 aminokyseliny.
Použitie monoklonálnych protilátok otvorilo dovtedy nedostupné možnosti štúdia mechanizmov funkčnej aktivity imunoglobulínov. Po prvýkrát sa pomocou monoklonálnych protilátok podarilo identifikovať antigénne rozdiely v proteínoch, ktoré boli predtým sérologicky nerozlíšiteľné. Boli stanovené nové podtypové a kmeňové rozdiely medzi vírusmi a baktériami, boli objavené nové bunkové antigény. Pomocou monoklonálnych protilátok boli detekované antigénne väzby medzi štruktúrami, ktorých existenciu nebolo možné spoľahlivo dokázať pomocou polyklonálnych (konvenčných imunitných) sér. Použitie monoklonálnych protilátok umožnilo identifikovať konzervatívne antigénne determinanty vírusov a baktérií so širokou skupinovou špecifickosťou, ako aj kmeňovo špecifické epitopy, ktoré sú vysoko variabilné a variabilné.
Zásadný význam má detekcia antigénnych determinantov pomocou monoklonálnych protilátok, ktoré indukujú tvorbu ochranných a neutralizačných protilátok proti patogénom infekčných chorôb, čo je dôležité pre tvorbu terapeutických a profylaktických liečiv. Interakcia monoklonálnych protilátok so zodpovedajúcimi epitopmi môže viesť k objaveniu sa stérických (priestorových) prekážok prejavu funkčnej aktivity proteínových molekúl, ako aj k alosterickým zmenám, ktoré transformujú konformáciu aktívneho miesta molekuly a blokujú biologická aktivita proteínu.
Len pomocou monoklonálnych protilátok bolo možné študovať mechanizmy kooperatívneho pôsobenia imunoglobulínov, vzájomnej potenciácie či vzájomnej inhibície protilátok smerujúcich proti rôznym epitopom toho istého proteínu.
Na produkciu masových množstiev monoklonálnych protilátok sa častejšie používajú ascitické nádory myší. Čistejšie prípravky monoklonálnych protilátok možno získať na bezsérových médiách vo fermentovateľných suspenzných kultúrach alebo v dialyzačných systémoch, v mikroenkapsulovaných kultúrach a zariadeniach, ako sú kapilárne kultúry. Na získanie 1 g monoklonálnych protilátok je potrebných približne 0,5 1 ascitovej tekutiny alebo 30 1 kultivačnej tekutiny inkubovanej vo fermentoroch so špecifickými hybridómovými bunkami. V produkčnom prostredí vyrábajú veľmi veľké množstvá monoklonálne protilátky. Značné náklady na výrobu monoklonálnych protilátok sú odôvodnené vysokou účinnosťou purifikácie proteínov na imobilizovaných monoklonálnych protilátkach a faktor purifikácie proteínov v jednostupňovom postupe afinitnej chromatografie dosahuje niekoľko tisíc. Afinitná chromatografia na báze monoklonálnych protilátok sa používa pri čistení rastového hormónu, inzulínu, interferónov, interleukínov produkovaných geneticky upravenými kmeňmi baktérií, kvasiniek alebo eukaryotických buniek.
Použitie monoklonálnych protilátok v diagnostických súpravách sa rýchlo rozvíja. Do roku 1984 bolo na klinické skúšky v Spojených štátoch odporúčaných asi 60 diagnostických testovacích systémov pripravených s použitím monoklonálnych protilátok. Hlavné miesto medzi nimi zaujímajú testovacie systémy na včasnú diagnostiku tehotenstva, stanovenie obsahu hormónov, vitamínov, liekov v krvi, laboratórna diagnostika infekčných ochorení.
Boli formulované kritériá na výber monoklonálnych protilátok na ich použitie ako diagnostických činidiel. Patrí medzi ne vysoká afinita k antigénu, ktorá zaisťuje väzbu pri nízkej koncentrácii antigénu, ako aj účinná konkurencia s protilátkami hostiteľa, ktoré sa už naviazali na antigény v testovanej vzorke; zacielenie proti antigénnemu miestu, ktoré zvyčajne nie sú rozpoznané protilátkami hostiteľského organizmu, a preto nie je týmito protilátkami maskované; zacielenie proti opakujúcim sa antigénnym determinantom povrchových štruktúr diagnostikovaného antigénu; polyvalencia, poskytujúca vyššiu aktivitu IgM v porovnaní s IgG.
Monoklonálne protilátky možno použiť ako diagnostické lieky na stanovenie hormónov a liečiv, toxických zlúčenín, markerov malígnych nádorov, na klasifikáciu a počítanie leukocytov, na presnejšie a rýchlejšie určenie krvnej skupiny, na detekciu antigénov vírusy, baktérie, prvoky, na diagnostiku autoimunitných ochorení, detekciu autoprotilátok, reumatoidných faktorov, stanovenie tried imunoglobulínov v krvnom sére.
Monoklonálne protilátky umožňujú úspešne diferencovať povrchové štruktúry lymfocytov a s vysokou presnosťou identifikovať hlavné subpoiulácie lymfocytov, klasifikovať bunky ľudskej leukémie a lymfómu do rodín. Nové reagencie na báze monoklonálnych protilátok uľahčujú stanovenie B-lymfocytov a T-lymfocytov, podtried T-lymfocytov, čo z neho robí jeden z najjednoduchších krokov na výpočet krvného vzorca. Pomocou monoklonálnych protilátok možno selektívne odstrániť jednu alebo druhú subpopuláciu lymfocytov, čím sa vypne zodpovedajúca funkcia bunkového imunitného systému.
Diagnostické prípravky na báze monoklonálnych protilátok zvyčajne obsahujú imunoglobulíny značené rádioaktívnym jódom, peroxidázou alebo iným enzýmom používaným v enzýmových imunoanalýzach, ako aj fluorochrómy, ako je fluoresceín izotiokyanát, používaný v imunofluorescenčnej metóde. Vysoká špecificita monoklonálnych protilátok je cenná najmä pri výrobe vylepšených diagnostických prípravkov, zvyšovaní senzitivity a špecificity rádioimunologických, enzýmových imunoanalýz, imunofluorescenčných metód sérologickej analýzy a typizácie antigénov.
Terapeutické využitie monoklonálnych protilátok môže byť účinné, keď je potrebné neutralizovať toxíny rôzneho pôvodu, ako aj antigénne aktívne jedy, dosiahnuť imunosupresiu pri transplantácii orgánov, vyvolať cytolýzu nádorových buniek závislú od komplementu, upraviť zloženie T -lymfocyty a imunoregulácia, na neutralizáciu baktérií odolných voči antibiotikám, pasívna imunizácia proti patogénnym vírusom.
Hlavnou prekážkou terapeutického použitia monoklonálnych protilátok je možnosť vzniku nežiaducich imunologických reakcií spojených s heterológnym pôvodom monoklonálnych imunoglobulínov. Aby sa to prekonalo, je potrebné získať ľudské monoklonálne protilátky. Úspešné štúdie v tomto smere umožňujú použiť monoklonálne protilátky ako vektory na cielené dodávanie kovalentne viazaných liečiv.
Vyvíjajú sa terapeutické lieky, ktoré sú špecifické pre presne definované bunky a tkanivá a majú cielenú cytotoxicitu. To sa dosiahne konjugáciou vysoko toxických proteínov, napríklad difterického toxínu, s monoklonálnymi protilátkami, ktoré rozpoznávajú cieľové bunky. Chemoterapeutické činidlá riadené monoklonálnymi protilátkami sú schopné selektívne ničiť nádorové bunky v tele, ktoré nesú špecifický antigén. Monoklonálne protilátky môžu tiež pôsobiť ako vektor, keď sú vložené do povrchových štruktúr lipozómov, čo zaisťuje dodanie významného množstva liečiv obsiahnutých v lipozómoch do cieľových orgánov alebo buniek.
Dôsledné používanie monoklonálnych protilátok nielen zvýši informačný obsah konvenčných sérologických reakcií, ale pripraví aj vznik zásadne nových prístupov k štúdiu interakcie antigénov a protilátok.
|
Skúmané parametre |
Typy protilátok |
||
|
senzibilizácia kože (reagins) |
blokovanie |
hemaglutinačný |
|
|
Princíp detekcie protilátok |
Reakcie s alergénom v koži |
Blokovanie reakcie alergén-reagin v koži |
Nepriama hemaglutinačná reakcia in vitro |
|
Stabilita pri t ° 50 ° |
Tepelne labilné |
Termostabilný |
Termostabilný |
|
Schopnosť prechádzať placentou |
Neprítomný |
Neexistujú žiadne údaje |
|
|
Schopnosť vyzrážať sa 30% síranom amónnym |
Nezrážať |
Obliehaný |
Čiastočne sa vyzráža, čiastočne zostáva v roztoku |
|
Chromatografia na DEAE-celulóze |
Rozptýlené vo viacerých frakciách |
V 1. frakcii |
V 1. frakcii |
|
Absorpcia imunosorbentmi |
Pomaly |
Neexistujú žiadne údaje |
|
|
Zrážanie peľových alergénov |
Nie, ani po koncentrácii protilátok |
Áno, po koncentrácii protilátok |
Precipitačná aktivita sa nezhoduje s hemaglutináciou |
|
Inaktivácia merkaptánu |
Deje sa |
Nedeje sa |
Neexistujú žiadne údaje |
|
Papain rozpad |
Pomaly |
Neexistujú žiadne údaje |
|
|
Sedimentačná konštanta |
Viac ako 7 (8-11) S |
||
|
Elektroforetické vlastnosti |
Prevažne γ1-globulíny |
γ2-globulíny |
Väčšina z nich je spojená s γ2-globulínmi |
|
Imunoglobulínová trieda |
|||
Bibliografia
Burnet F. Bunková imunológia, trans. z angličtiny, M., 1971; Gaurovi c F. Imunochémia a biosyntéza protilátok, trans. z angličtiny, M., 1969, bibliogr.; Dosse J. Immunohematology, trans. z francúzštiny, M., 1959; Zdrodovský PF Problematika infekcie, imunity a alergií, M., 1969, bibliogr.; Imunochemická analýza, ed. L.A. Zilber, s. 21, M., 1968; Cabot E. a Meyer M. Experimental immunochemistry, trans. z angličtiny, M., 1968, bibliogr.; Nezlin R.S. Štruktúra biosyntézy protilátok. M., 1972, bibliogr.; Nosse l G. Protilátky a imunita, trans. z angličtiny, M., 1973, bibliogr.; Petrov RV Formy interakcie geneticky odlišných buniek lymfoidných tkanív (trojbunkový systém imunogenézy), Usp. moderné biol., v. 69, v. 2, str. 261, 1970; Uteshev BS a Babichev VA Inhibítory biosyntézy protilátok. M., 1974; Efroimson V. P. Immunogenetics, M., 1971, bibliogr.
Alergický A.- Ado AD Alergia, Mnogotom. US Pat. fiziol., ed. H. N. Sirotinina, t. 1, s. 374, M., 1966, bibliogr.; Ado AD Všeobecná alergológia, s. 127, M., 1970; Polner A. A., Vermont I. E. a Serova T. I. K otázke imunologickej povahy reaginov pri sennej nádche v knihe: Probl. allergol., ed. A. D. Ado a A. A. Podkolzin, s. 157, M., 1971; Bloch K. J. Anafylaktické protilátky cicavcov vrátane človeka, Progr. Alergia, v. 10, str. 84, 1967, bibliogr.; Ishizaka K. a. Ishizaka T. Význam imunoglobulínu E pri reaginickej hypersenzitivite, Ann. Alergia, v. 28, str. 189, 1970, bibliogr.; Lichtenstein L. M., Levy D. A. a. Ishizaka K. In vitro reverzná anafylaxia, charakteristika anti-IgE sprostredkovaného uvoľňovania histamínu, Immunology, v. 19, str. 831, 1970; Sehon A. H. Heterogenita protilátok v alergických sérach, in: Molec. a. bunkový základ tvorby protilátok, ed. od J. Sterzla, s. 227, Praha, 1965, bibliogr.; Stanworth D. R. Imunochemické mechanizmy hypersenzitívnych reakcií okamžitého typu, Clin. exp. Immunol., W. 6, str. 1, 1970, bibliogr.
Monoklonálne protilátky- Hybridómy: nová úroveň biologickej analýzy, ed. RG Kenneth a ďalší, M., 1983; Rokhlin OV Monoklonálne protilátky v biotechnológii a medicíne, v knihe: Biotechnology, ed. A. A. Baeva, s. 288, M., 1984; N о w i n s k i R. C. a. o. Monoklonálne protilátky na diagnostiku infekčných chorôb u ľudí, Science, v. 219, s. 637, 1983; Ollson L. Monoklonálne protilátky v klinickej imunobiológii, Derivácia, potenciál a obmedzenia, Alergia, v. 38, s. 145, 1983; Sinko sa uchádza o J. G. a. D r e e s m a n G. R. Monoklonálne protilátky hybridómov, Rev. infikovať. Dis., V. 5, str. 9, 1983.
M. V. Zemskov, H. V. Zhuravleva, V. M. Zemskov; A. A. Polner (všetci); A. K. Tumanov (súd); A. S. Novokhatsky (Monoklonálne protilátky).
Alergické protilátky sú veľkou skupinou ľudských a zvieracích krvných globulínov. Najdôležitejším rozdielom medzi protilátkami a „normálnymi“ globulínmi je ich imunologická špecifickosť a biologická schopnosť vyvolať určité alergické reakcie.
Mnohé imunitné protilátky majú vlastnosti alergických protilátok. Takže napríklad antitoxíny na bakteriálne exotoxíny sa podieľajú na mechanizme anafylaktického šoku spôsobeného týmito toxínmi („toxínová anafylaxia“ podľa IV Morgunova, 1963 atď.), lyzíny a protilátky viažuce komplement spôsobujú alergické reakcie „reverzného typu" cytotoxický "šok a rôzne alergické reakcie cytolýzy (Forssman, 1911; Waksman, 1962).
Širokú skupinu alergických reakcií spôsobujú protilátky, ako sú precipitáty a aglutiníny; Arthusov fenomén, Overyho fenomén, anafylaktický šok u králikov, sérová choroba, alergia na lieky (Artlius, 1903; Pirquet, 1907; Ovary, 1958). Spomedzi protilátok tejto skupiny sa na mechanizme alergických reakcií podieľajú také typy procytypov a aglutinínov, ktoré neboli detegované bežnými metódami kruhovej precipitácie, priamej makro- a mikroaglutinácie a pod.. Tieto protilátky boli nájdené v krvi ľudí so sérovou chorobou alebo zvieratami.s anafylaktickou senzibilizáciou po odstránení precipitínov z krvi špecifickým antigénom. Po odstránení precipitínov si krvné sérum zachovalo schopnosť pasívne prenášať stav celkovej alebo lokálnej anafylaxie. Richefc (1907) a potom Friedberger (1909) nazvali tieto protilátky anafylaktické.
Neskôr, pri štúdiu množstva foriem alergických ochorení (senná nádcha, „atopické“ ochorenia, imunohematologické ochorenia) boli identifikované špeciálne typy alergických protilátok. Niektoré z nich vykazovali vlastnosti precipitínov alebo aglutinínov len vtedy, keď špeciálne podmienky alebo špeciálna technika ich detekcie (koprecipitačná reakcia, aglutinácia erytrocytov vopred ošetrených tanínom a pod.). Tieto alergické protilátky sú známe ako "ienrecinujúce" ("nekompletné"), alergické chladové aglutiníny atď.
Táto skupina alergických protilátok zaujíma akoby medzipolohu medzi plnohodnotnými zrážkami a aglutinínmi a skupinou alergických protilátok, ktoré spôsobujú senzibilizáciu kože zdravého človeka po podaní, teda krvné sérum pacienta s pollino ,
alebo iný typ okamžitej (chimergickej) alergie "typ (alergia na plesne, prach, potraviny a iné alergény). Posledný typ protilátok Sosa (1925) nazývaný" reaginuje ", alebo" atopypes "(priezvisko nebolo prijaté v r. Biologické a fyzikálne - chemické vlastnosti reaginov sa výrazne líšia od vlastností všetkých známych imunitných protilátok.
Absolútne unikátne protilátky podieľajúce sa na mechanizme alergických reakcií oneskoreného typu a niektorých okamžitých alergických reakcií sú takzvané tkanivové alebo bunkové fixované protilátky. Vlastnosti a mechanizmus účinku týchto protilátok ešte neboli dostatočne študované. Na mechanizmoch rôznych alergických reakcií sa teda podieľa mnoho typov protilátok, od protilátok s biologickými a fyzikálno-chemickými vlastnosťami imunitného systému až po špeciálne typy protilátok, ktoré nemajú nič spoločné s protilátkami vyvolávajúcimi imunitné reakcie.
Všetky alergické protilátky možno rozdeliť do dvoch veľkých skupín. Do prvej skupiny patria protilátky krvi a iných biologických tekutín (humorálne protilátky), do druhej skupiny protilátky, ktoré sedia na bunkách – tkanivové, fixované alebo „sossilpy“ (bunkové protilátky). Poslednú skupinu protilátok si netreba zamieňať s humorálnymi protilátkami, ktoré sú sekundárne fixované na bunkách hladkého svalstva, na iných tkanivách s pasívnou anafylaxiou a okamžitou alergiou (Schultz-Daleova reakcia, pasívna kožná anafylaxia – Overyho fenomén, pasívny anafylaktický šok atď.). ).
Vzťah medzi rôznymi typmi alergických protilátok môže byť znázornený ako nasledujúci diagram (schéma 7).
Schéma 7
INTERAKCIE RÔZNYCH DRUHOV ALERGICKÝCH PROTILÁTOK Alergické protilátky
"Bezplatné pevné (mobilné)
P o d a p e n t e n e n e n t e n e n t e n e n e n t e n t
Kojio-seisbilizačné blokovanie (ochranné protilátky)
(reagin)
Biologické a fyzikálno-chemické vlastnosti normálnych a imunoglobulínov v ľudskom a zvieracom krvnom sére sú v centre pozornosti moderných biochemikov a imunológov.
Pohľad na protilátky, vrátane alergických, ako zmenené krvné globulíny, vyvinuli u nás V. A. Barykin (1927), N. F. Gamaleya (1928) v podobe doktríny imunity ako funkcie koloidného stavu krvných bielkovín ( VA Barykip) alebo Lee vo forme teórie odtlačkov (NF Gamaleya), následne vyvinutej Paulingom a Haurowitzom a mnohými ďalšími imunológmi.
Humorálne alergické protilátky spolu s imunogénnymi protilátkami predstavujú veľkú rodinu globulínov, ktoré získali schopnosť špecificky sa viazať na širokú škálu alergénov,
ktoré spôsobili ich vznik alebo majú s nimi spoločné determinantné skupiny. Podľa Grabara (1963) protilátky, imunitné aj alergické, vyjadrujú z fyziologického hľadiska transportnú funkciu krvných globulínov v rovnakej miere, ako je to známe pri prenose sacharidov (glykoproteínov), lipoidov (lipoproteínov) a iných látok. globulínmi. Je zrejmé, že v prípade protilátok táto transportná funkcia súčasne získava vysoký stupeň imunologickej špecifickosti, čím poskytuje protilátkam ich ochranné alebo agresívne účinky.
Špecifickosť niektorých alergických protilátok je relatívna. Keď sú králiky senzibilizované jedným typom rastlinného peľu, vznikajú protilátky proti mnohým typom peľových alergénov (A.D. Ldo et al., 1963). Na klinike pollipózy sa zvyčajne pozoruje polyvalentná citlivosť na mnohé druhy peľu zo stromov a tráv. Pri sérovej chorobe, reumatizme sa pozorujú protilátky, ktoré aglutinujú a lyzujú ovčie erytrocyty (heterofilné forsman protilátky), ako aj precipitáciu na krvné bielkoviny mnohých druhov cicavcov (králik, mačka, pes, potkan, myš atď.).
Cooke a Sherman (1940) preukázali možnosť reakcie alergických protilátok s mnohými alergénmi pri pasívnej prenosovej reakcii. Keď je králik imunizovaný krvným sérom barana, vytvárajú sa precipitáty aj na proteíny krvi ľudí, koní a ošípaných (Landsteiner, van Sclicer, 1939, 1940).
Alergická reakcia od imunitnej odpovede sa líši poškodením vlastných tkanív. Zápal hyperergickej povahy, edém, bronchospazmus, pruritus, cytotoxické a cytolytické účinky, šok – všetky tieto klinické príznaky alergickej reakcie sú prejavom poškodenia spôsobeného imunitným mechanizmom [Pytskiy VI et al., 1984]. Jeden z charakteristické znaky Alergické ochorenie je tvorba alergických protilátok. Pri štúdiu alergických ochorení (polynózy, „atopické“ ochorenia, imunohematologické ochorenia a pod.) sa našlo viacero funkčne odlíšiteľných alergických protilátok. Vzťah rôznych typov alergických protilátok podľa A. D. Ado (1970) je znázornený v schéme 1:
Podľa klasifikácie AD Ado sa alergické protilátky delia do dvoch skupín: protilátky krvi a iných biologických tekutín (humorálne protilátky) a tkanivové protilátky (fixné, „silné“, bunkové). Alergické protilátky, podobne ako imunitné protilátky, patria k imunoglobulínom. Majú tú vlastnosť, že sa špecificky spájajú s alergénmi, ktoré spôsobili ich tvorbu, alebo majú s nimi spoločné determinantné skupiny [Ado AD, 1970]. Existuje päť typov imunoglobulínov, ktoré sa líšia fyzikálnymi a chemickými vlastnosťami: IgG, IgA, IgM, IgD, IgE.
Alergické protilátky (reagins) patria najmä do piateho typu imunoglobulínov - IgE, ale medzi nimi sú aj reaginy triedy so sedimentačným koeficientom okolo 7. Predpokladá sa, že LgE sa syntetizuje v lymfoidnom tkanive slizníc a lymfatických uzlín, a preto dýchacie orgány sú šokové orgány v reaginovom type reakcie, črevá, spojovky. Reaginózny typ reakcie je základom atopických ochorení (atopická dermatitída, senná nádcha, bronchiálna astma atď.). Reaginy alebo kožne senzibilizujúce protilátky sa nachádzajú v krvnom sére pacientov s okamžitým typom precitlivenosti a majú schopnosť senzibilizovať kožu, ako aj sliznicu nosa, očí a dýchacích ciest, ktorá je stanovená pomocou alergologických testov.
Výskyt blokujúcich protilátok zistených pri RPHA je spojený s ochranným faktorom proti škodlivému účinku alergénu. Úloha blokovania alergických protilátok však nie je úplne pochopená. Precipitujúce alergické protilátky sa podieľajú na imunokomplexnej patológii, väzbe komplementu - pri alergických reakciách rôznych typov (tuberkulín, anafylaktická, pollinóza, ekzém).
Na alergickej reakcii sa spravidla podieľajú nielen B-, ale aj efektorové T-lymfocyty. Prevažujúci vývoj reakcie v jednom alebo druhom smere je do značnej miery určený dávkou, chemickou štruktúrou a fyzikálno-chemickým stavom antigénu. Vplyvom alergénu a medzibunkových interakcií dochádza k aktivácii lymfocytov, čo je sprevádzané prudkými biochemickými zmenami. V prvom rade sú zaregistrovaní v bunková membrána: zvyšuje sa ich priepustnosť pre mnohé látky, mení sa aktivita cykláz, ktoré regulujú hladinu cyklických nukleotidov cyklického adenozínmonofosfátu (cAMP) a cyklického guanozínmonofosfátu (cGMP). Prevaha prvého určuje prevalenciu procesu dozrievania buniek, prevaha druhého znamená zvýšenie bunkového delenia. Početné biochemické zmeny sú zaznamenané aj v cytoplazme, granulách a bunkovom jadre. Dokončuje sa proces aktivácie lymfocytov so syntézou DNA v bunkách, zvyšuje sa syntéza RNA a proteínu.
Efektorové T-lymfocyty (T-killery) vylučujú mediátory, ktoré určujú ich biologický účinok (napríklad lymfotoxíny). Výrazné zmeny sa týkajú ich membrán: mení sa obsah niektorých makromolekúl na ich povrchu, niektoré markery zanikajú, iné sa objavujú. Zabíjačské T bunky nestrácajú receptory pre antigén: potrebujú ich na rozpoznanie cieľových buniek, na ktoré pôsobia.
Spomedzi bunkových mechanizmov cytolýzy je najviac študovaná cytotoxicita spôsobená imunitnými zabíjačskými T bunkami. Cytolýza T-buniek pozostáva z niekoľkých fáz: nadviazanie kontaktu medzi zabíjačom a cieľovou bunkou (táto fáza je reverzibilná – bunkové delenie zabraňuje smrti cieľových buniek), programovaná lýza (cieľová bunka vyzerá životaschopne, ale je odsúdená na smrť) a dokončenie lýzy. Cieľové bunky usmrtené jedným z týchto mechanizmov sú potom eliminované makrofágmi a inými fagocytárnymi bunkami.
- Mechanizmus vzniku alergických ochorení závisí od účasti rôznych alergických protilátok a T-efektorových lymfocytov. AD Ado rozdeľuje všetky alergické reakcie na pravdivé, či skutočne alergické a falošné, alebo pseudoalergické (neimunologické). Pravda, alebo vlastne alergický, autor ďalej delí na chimergické (B-závislé) a cytergické (T-závislé). Najrozšírenejšia v alergológii je Gell-Coombsova klasifikácia, podľa ktorej by sa mali rozlišovať alergické reakcie:
- Typ I - anafylaktický, na ktorom sa podieľajú protilátky IgE a menej často IgG4;
- Typ II - cytotoxický s účasťou protilátok IgG a IgM počas adsorpcie alergénu na cieľové bunky;
- Typ III (typ Artyus) - poškodenie imunitným komplexom za účasti protilátok IgG a IgM;
- Typ IV - oneskorená precitlivenosť, realizovaná T-lymfocytmi.
Mechanizmus alergickej reakcie oneskoreného typu spočíva v nasledujúcom: keď alergén vstúpi do tela, vytvoria sa senzibilizované lymfocyty. Ide o T-populácie lymfocytov, ktoré majú v membráne zabudované štruktúry, ktoré plnia úlohu protilátok a sú schopné viazať sa na antigén. Pri opätovnom vstupe do tela sa alergén spája so senzibilizovaným lymfocytom, čo vedie k aktivácii a proliferácii buniek, zvýšenej syntéze DNA a RNA a sekrécii lymfokínových mediátorov. Niektoré lymfokíny podporujú mobilizáciu rôznych buniek, iné (s chemotaktickou aktivitou) - aktivujú chemotaxiu makrofágov, polymorfonukleárnych buniek k umiestneniu alergénu. Pod vplyvom iných mediátorov sa zdržujú na tomto mieste, zvyšuje sa ich fagocytárna aktivita. Okrem toho majú lymfokíny cytotoxický, bunkový inhibičný účinok. Zabíjačské lymfocyty môžu mať priamy cytotoxický účinok na cieľové bunky. V mieste, kde sa lymfocyt spája s bunkami adsorbovaným alergénom, dochádza k deštrukcii týchto buniek, následne k fagocytóze bunkového odpadu a zvyšuje sa priepustnosť ciev, čiže obraz zápalovej reakcie produktívneho typu. rozvíja.
Imunologické štádium precitlivenosti oneskorený typ je charakterizovaný aktiváciou imunitného systému závislého od týmusu. Senzibilizované lymfocyty v ohnisku alergickej reakcie tvoria 1-2%. Zvyšok nesenzibilizovaných buniek priťahuje pôsobenie lymfokínov. Patochemické štádium alergickej reakcie IV. typu je charakterizované uvoľňovaním mediátorov – lymfokínov v dôsledku interakcie T- a B-lymfocytov s alergénmi. Nasledujúce lymfokíny sú najviac študované:
- 1. Faktor, ktorý inhibuje migráciu makrofágov (MIF), prispieva k akumulácii makrofágov v oblasti alergických zmien, zvyšuje ich aktivitu a fagocytózu.
- 2. Faktor, ktorý stimuluje tvorbu endogénnych pyrogénov.
- 3. Mitogénne faktory: lymfocytový mitogénny faktor (LMP), interleukín 1 makrofágového pôvodu a interleukín 2 vylučovaný T-pomocníkmi.
- 4. Chemotaktický faktor vedúci k chemotaxii zodpovedajúcich leukocytov (makrofágy, neutrofilné, bazofilné a eozinofilné granulocyty).
- 5. Lymfotoxíny spôsobujúce poškodenie alebo deštrukciu rôznych cieľových buniek.
- 6. Kožný reaktívny faktor, od ktorého závisí závažnosť zápalu. Zníženie uvoľňovania kožného reaktívneho faktora krvnými lymfocytmi naznačuje potlačenie bunkovej imunity.
- 7. Transfer faktor, ktorý prenáša „imunologickú pamäť“ senzibilizačného alergénu.
Okrem mediátorov lymfocytov a makrofágov sa na poškodzujúcom účinku podieľajú lyzozomálne enzýmy, kiníny a iné systémy.
Patofyziologické štádium alergickej reakcie oneskorený účinok je charakterizovaný škodlivým účinkom senzibilizovaných lymfocytov na cieľovú bunku. Cytotoxický účinok T-lymfocytov je možný prostredníctvom lymfotoxínu, nepriamo a tiež v dôsledku uvoľňovania lyzozomálnych enzýmov v procese fagocytózy.
Mediátory patochemického štádia alergickej reakcie IV. typu tvoria zápal, ktorý je na jednej strane ochranným faktorom, na druhej strane faktorom poškodenia, dysfunkcie orgánu, kde vzniká.
V prípade alergických reakcií okamžitého typu je potrebná prítomnosť humorálnych protilátok, čo sú proteíny daného typu a viažu sa len na špecifické antigény. Komplex antigén-protilátka spôsobuje v tele rôzne poškodenia. Rozpustné antigény najčastejšie spôsobujú precipitačné reakcie; antigény vo forme erytrocytov, baktérií, vírusov, koloidných častíc pri kombinácii so špecifickými protilátkami - aglutinačná reakcia. Na detekciu protilátok v imunológii sa používajú rôzne reakcie.
Protilátky sú produkované lymfoidnými bunkami lymfatických uzlín, sleziny, kostnej drene, mandlí. Môžu sa nachádzať v krvi 7-15 dní po injekcii alergénu. Maximálna hladina protilátok sa v krvi pozoruje niekoľko týždňov alebo dlhšie, potom sa produkcia protilátok zníži a v minimálnych množstvách sa dajú v krvi zistiť aj niekoľko mesiacov. Životnosť protilátok cirkulujúcich v krvi je 20 dní; to naznačuje dlhodobú syntézu ich imunokompetentných buniek.
Protilátky sa týkajú sérových globulínov. Väčšina novorodených cicavcov má veľmi málo globulínov – chýbajú im protilátky. V priebehu niekoľkých týždňov po pôrode dochádza k zvýšeniu krvných globulínov a paralelne k zvýšeniu hladiny protilátok.
U novorodenca je hladina gama globulínov blízka normálu, ale väčšina z týchto gama globulínov je materská. Obsah gamaglobulínov sa počas prvých dvoch mesiacov života znižuje, pretože produkcia globulínov je extrémne slabá. Až v treťom mesiaci života dosahuje produkcia gamaglobulínov určitú úroveň.
Pomocou metódy elektroforézy je možné oddeliť rôzne proteínové frakcie krvného séra a určiť, ku ktorým globulínovým frakciám protilátky patria.
Zistilo sa teda, že protilátky patria do rôznych frakcií globulínov – od gama po alfa (ide o imunoglobulíny) (obr. 5).
Ryža. 5. Imunoelektroforéza normálneho krvného séra.
Protilátky, ktoré sa tvoria v tele pri rôznych infekciách, očkovaniach, sa vo väčšine prípadov týkajú gamaglobulínov s molekulovou hmotnosťou do 180 000. V prvej fáze tvorby protilátok sa zisťujú makroglobulíny s molekulovou hmotnosťou do 900 000. Hlavnou vlastnosťou protilátok je ich schopnosť viazať sa na antigény alebo presnejšie na určité zoskupenia ich molekúl, ktoré spôsobili tvorbu protilátok. Chemická štruktúra týchto antigénovo špecifických skupín je stále neznáma. Predpokladá sa, že špecifickosť protilátok je určená množstvom polypeptidov alebo tromi až štyrmi molekulami cukru.
„Oblasť“ molekuly protilátky, ktorá hrá úlohu v reakcii antigén-protilátka, je veľmi malá. Moderné imunologické výskumné metódy (difúzia, elektroforéza, ultracentrifugácia) umožnili zistiť, že väčšina imunitných protilátok má na každej molekule dve špecifické „miesta“, cez ktoré sa protilátka viaže na špecifický antigén – to sú valencie protilátok. Stupeň príťažlivosti antigénu a protilátky je určený elektrostatickými a intermolekulárnymi silami, ktorými disponujú makromolekuly, ako aj iné: Coulombove sily, van der Waalsove sily, ako aj vodíkové väzby a kovalencia. To všetko určuje charakteristickú štruktúru molekuly proteínu.
Reakcia antigén-protilátka je veľmi rýchla. Odhaduje sa, že ku kompletnej kombinácii proteínu a antiproteínu dôjde v priebehu niekoľkých sekúnd pri 0 °C.
K tvorbe komplexu antigén-protilátka dochádza v dôsledku duálnej valencie protilátok a polyvalencie antigénov. Reakcia medzi bivalentnými a polyvalentnými molekulami podľa Marracka vedie k vzniku zlúčeniny, ktorej veľkosť sa s pripájaním nových molekúl neustále zväčšuje – vznikajú konglomeráty, ktorých počet hydrofilných skupín klesá, čím vznikajú nerozpustné zrazeniny.
Precipitačná reakcia je veľmi špecifická a pomocou mnohých metód je možné precipitujúce protilátky v krvnom sére nielen detegovať, ale aj určiť ich hladinu.
Mechanizmus aglutinačnej reakcie má veľa spoločného s mechanizmom precipitačnej reakcie. Antigénom v týchto reakciách sú baktérie, krvinky a inertné častice potiahnuté rozpustným antigénom na vrchu. Pri tejto reakcii sa protilátky viažu na antigény na povrchu buniek a častíc.

Ryža. 6. Schéma komplexu antigén-protilátka. A - oblasť prebytočného antigénu; B - bod ekvivalencie; B - oblasť nadbytočných protilátok.
V dôsledku bivalencie protilátok sa každá molekula protilátky spája s dvoma časticami antigénu, čím medzi nimi vzniká akýsi mostík (obr. 6), pričom dochádza k aglutinácii buniek alebo častíc. Aglutinačná reakcia je prísne špecifická.
Existuje mnoho aglutinačných testovacích metód, ktoré možno použiť na stanovenie hladiny aglutinačných protilátok v krvnom sére. Tieto reakcie sú vysoko citlivé a dostatočne presné. Pre sérologické reakcie sa používa najvyššie riedenie imunitného séra, ktoré poskytuje aglutináciu s mikrobiálnymi telieskami alebo krvinkami suspendovanými vo fyziologickom roztoku. V imunológii sa uskutočňuje nepriama reakcia, pričom sa používajú normálne jahňacie alebo ľudské erytrocyty, na ktorých je fixovaný antigén. Erytrocyty môžu byť tiež umiestnené na inertných časticiach: latex, kolodium, polyisterón atď. Stanovte najväčšie riedenie séra, ktoré poskytuje viditeľnú aglutináciu. Rôzne modifikácie aglutinačnej reakcie umožňujú detekovať protilátky na veľmi nízkej hladine – do 0,005 μg protilátkového proteínového dusíka v 1 ml.
Pri vývoji alergických reakcií okamžitého aj oneskoreného typu možno rozlíšiť nasledujúce štádiá (AD Ado):
- 1) štádium imunitných odpovedí;
- 2) štádium patochemických porúch;
- 3) štádium patofyziologických porúch.
Štádium imunitných reakcií
Štádium imunitných reakcií je charakterizované akumuláciou protilátok špecifických pre daný alergén v organizme. Počiatočné štádiá vývoj alergickej reaktivity v mnohom pripomína vývoj imunity (odtiaľ názov "štádium imunitných reakcií"), konkrétne alergén je fixovaný v bunkách retikuloendotelového systému a spôsobuje plazmatizáciu lymfoidných buniek. V druhom prípade začína tvorba protilátok. Alergické protilátky, podobne ako imunitné, majú vysoký stupeň špecifickosti, to znamená, že sa viažu iba na alergén, ktorý spôsobil ich tvorbu. Alergické protilátky sa nachádzajú v globulínových frakciách sérových proteínov. Miesto a mechanizmus tvorby alergických protilátok sa zásadne nelíši od imunitných protilátok. Výskyt špecifických alergických protilátok v organizme určuje stav senzibilizácie, teda objavenie sa precitlivenosti na niektorý alergén (z lat. sensibilis - citlivý). Rozlišujte senzibilizáciu aktívny a pasívny .
Aktívna senzibilizácia vzniká pri vpravení alergénu do tela zvieraťa parenterálnou cestou (intramuskulárne, subkutánne, do vankúšikov chodidiel, do brušnej dutiny, do likvoru, inhaláciou a pod.). Na senzibilizáciu stačí veľmi malé množstvo alergénu – rádovo stotiny a tisíciny gramu (obr. 14). Stav precitlivenosti sa neobjaví hneď po injekcii alergénu, ale po 10-14 dňoch, pretrváva u zvierat 2 mesiace a viac a potom postupne vymizne. U ľudí môže senzibilizácia pretrvávať mesiace a roky.
V procese senzibilizácie sa zvyšuje fagocytárna aktivita buniek retikuloendotelového systému, začína sa plazmatizácia lymfoidných buniek a začína sa v nich tvorba protilátok.
Od prvých dní senzibilizácie v kmeňoch somatických a autonómnych nervov sa pozoruje zvýšenie excitability, funkčná mobilita podľa N. E. Vvedenského a skrátenie chronaxie. Receptory vnútorné orgány a krvné cievy podliehajú fázovým zmenám, ich excitabilita sa najprv zvyšuje a potom je inhibovaná.
Pasívna senzibilizácia nastáva, keď sa zdravému zvieraťu injekčne podá sérum iného aktívne senzibilizovaného zvieraťa (pre morča 5-10 ml, pre králika 15-20 ml). Stav precitlivenosti nastáva 18-24 hodín po podaní séra. Tento čas je potrebný na to, aby sa protilátky obsiahnuté v cudzom sére fixovali v tkanivách tela.
Orgány izolované z tela (črevá, maternica, pľúca atď.) môžu byť tiež pasívne senzibilizované umiestnením do prostredia s protilátkami; zavedenie hotových protilátok do kože spôsobuje jej lokálnu pasívnu senzibilizáciu.
Vlastnosti alergických protilátok
Alergické protilátky sú modifikované krvné globulíny. Ich najdôležitejšie biologické vlastnosti sú:
- a) imunologickej špecifickosti, to znamená schopnosť kombinovať sa s alergénom, ktorý spôsobil tvorbu týchto protilátok;
- b) schopnosť po spojení s alergénom vyvolať určité alergické reakcie.
Všetky alergické protilátky možno rozdeliť do dvoch skupín:
- 1) fixné (alebo bunkové) protilátkyúzko spojené s bunkami a zapojené do alergických reakcií oneskoreného typu;
- 2) voľné (alebo cirkulujúce) protilátky nachádzajúce sa v krvi a iných telesných tekutinách a spôsobujúce okamžité alergické reakcie.
Cirkulujúce protilátky rozdelený na zrážavá a nezrážavá ... Medzi posledné patria takzvané reaginy, ktoré blokujú protilátky, a niektoré ďalšie.
Precipitujúce protilátky (IgG) sa nachádzajú v krvi pri ľudskej sérovej chorobe, anafylaktickom šoku u ľudí a zvierat, alergickom zápale u králikov (Arthusov fenomén), alergických reakciách na vaječný bielok, konských lupinách a niektorých ďalších alergických reakciách. Precipitíny sú tepelne stabilné.
Reagins alebo protilátky senzibilizujúce pokožku IgE sa objavuje v krvnom sére pacientov so sennou nádchou alebo atónovou bronchiálnou astmou. Reaginy nie sú detegované konvenčnými sérologickými reakciami in vitro (precipitácia, väzba komplementu atď.), ale môžu pasívne senzibilizovať pokožku zdravého človeka, a preto sa nazývali protilátky senzibilizujúce kožu. Najspoľahlivejším spôsobom detekcie reaginov je Prausnitz-Küstnerova reakcia (reakcia pasívnej senzibilizácie kože). Zdravému človeku sa intradermálne podáva sérum alergického pacienta v objeme 0,05-0,1 ml. O deň neskôr sa na to isté miesto vstrekne špeciálne vybraná dávka alergénu. Pri pozitívnej reakcii vzniká hyperémia, edém, svrbenie (obr. 14).
Reaginy sú termolabilné, ich aktivita výrazne klesá po zahriatí séra na 56 ° po dobu 2-4 hodín. Najdôležitejšou biologickou vlastnosťou reaginov je ich „bišpecifickosť“, teda schopnosť spojiť sa na jednej strane s bunkou citlivého zvieraťa a na druhej strane s antigénom. Práve vďaka fixácii na bunky sa prejavuje poškodzujúca schopnosť reaginov.
Fixné alebo bunkové protilátky podieľať sa na mechanizme oneskorenej alergie. Na základe skutočnosti, že oneskorená alergia sa môže preniesť na iné zviera alebo človeka len pomocou buniek (lymfocytov) senzibilizovaného organizmu, dospelo sa k záveru, že protilátka spôsobujúca oneskorenú alergiu musí byť obsiahnutá v bunkách. Niekedy sa označuje ako "prenosový faktor" senzibilizácie. Tento faktor sa uvoľňuje zo senzibilizovanej bunky (lymfocytov a iných buniek) a cez tekuté tkanivové médiá sa dostáva do iných buniek. Pôsobením na ne v nich vyvoláva senzibilizačný stav, opäť ich oslobodzuje a senzibilizuje nasledujúce bunky. Týmto spôsobom môže malé množstvo alergénu senzibilizovať veľké množstvo buniek. Povaha faktora prenosu nie je presne známa. Známe sú len niektoré jeho vlastnosti; u ľudí je odolný voči pôsobeniu RNAázy, DNázy, trypsínu, je schopný prejsť cez dialyzačnú membránu a má molekulovú hmotnosť asi 10 000.
Štádium patochemických zmien
Ak sa špecifický alergén znovu zavedie do senzibilizovaného organizmu (t. j. obsahujúceho alergické protilátky), potom dôjde k fyzikálno-chemickej reakcii medzi protilátkami a alergénom a vytvorí sa makromolekulárny komplex alergén-protilátka. Tento komplex sa fixuje v tkanivách a spôsobuje množstvo metabolických zmien. V prvom rade sa mení množstvo kyslíka absorbovaného tkanivami, má fázový charakter (najskôr nárast, potom pokles).
Pod vplyvom komplexu alergén-protilátka sa aktivujú tkanivové a bunkové proteolytické a lipolytické enzýmy, čo vedie k narušeniu funkcií zodpovedajúcich buniek. Napríklad dôsledkom poškodenia žírnych buniek spojivového tkaniva, krvných leukocytov (najmä bazofilov a neutrofilov) je uvoľňovanie histamínu, serotonínu a niektorých ďalších biologicky aktívnych látok z nich.
Histamín... U ľudí a zvierat je histamín obsiahnutý v žírnych bunkách spojivového tkaniva, krvných bazofiloch, v menšej miere v neutrofilných leukocytoch, krvných doštičkách, v hladkých a priečne pruhovaných svaloch, pečeňových bunkách, epiteli gastrointestinálny trakt atď.
Účasť histamínu na mechanizme alergie sa prejavuje tým, že spôsobuje spazmus hladkého svalstva (napríklad priedušiek, maternice, čriev atď.) a zvyšuje priepustnosť krvných kapilár, čo spôsobuje edém, žihľavku, petechie atď. Okrem toho histamín zvyšuje hydrofilitu voľných vlákien spojivového tkaniva, čím prispieva k viazaniu vody v tkanivách a vzniku rozsiahleho edému, akým je angioedém (obr. 15).

Histamín sa podieľa na mechanizmoch alergických reakcií u ľudí, ako je svrbenie, žihľavka a krátkodobá hypotéza. Hypotenzívne reakcie, ako sú kolapsy (alebo šok), sú s najväčšou pravdepodobnosťou spôsobené účasťou kinínov (bradykinín) a pretrvávajúci bronchospazmus (pri bronchiálnej astme) je spôsobený pôsobením takzvanej pomaly reagujúcej látky na bronchiálny strom.
Pomaly reagujúca alergická látka (MRS-A)... Je to látka podobná chemickej štruktúre kyseline neuramínovej alebo glukozidom týchto kyselín. Táto látka spôsobuje pomalú kontrakciu orgánov hladkého svalstva na rozdiel od rýchlej kontrakcie spôsobenej histamínom. MRS-A spôsobuje spazmus ľudských bronchiolov, jeho aktivitu nepotláčajú antihistaminiká a proteolytické enzýmy. Miestom tvorby MPC-A pri alergických reakciách sú žírne bunky spojivového tkaniva. Predpokladá sa, že táto látka má veľký význam pri výskyte bronchospazmu pri bronchiálnej astme u ľudí.
Serotonín(5-hydroxytryptamín) – nachádza sa takmer vo všetkých tkanivách tela, ale najmä v žírnych bunkách spojivového tkaniva, slezinných bunkách, krvných doštičkách, argentofilných a enterochromafínových bunkách žalúdka, pankreasu, v niektorých nervových bunkách, najmä v hypotalamu.
Informácie o účasti serotonínu na alergických reakciách sú dosť rozporuplné. Pri pokusoch na zvieratách sa zistilo, že u morčiat, mačiek, potkanov vyvoláva bronchospazmus. U potkanov a myší sa serotonín uvoľňuje zo žírnych buniek pod vplyvom bielok dextrán a niektoré ďalšie látky. Vyskytuje sa ostrý edém tváre, semenníkov, labiek (anafylaktoidná reakcia).
Pri alergických reakciách u ľudí nie je serotonín nevyhnutný.
Bradykinín- polypeptid pozostávajúci z 9 ľavotočivých aminokyselín (arginyl-prolyl-prolyl-glycyl-fenylalanyl-seryl-prolyl-fenylalanyl-arginín). Vzniká z alfa-2-globulínu v krvi pod vplyvom proteolytických enzýmov. Pri anafylaktickom šoku sa aktivujú proteolytické enzýmy v dôsledku pôsobenia komplexu alergén-protilátka na bunkové proteázy, ako je kallidin, kallikrein.
Bradykinín sa podieľa na patogenéze anafylaktického šoku u ľudí a zvierat: rozširuje krvné kapiláry, zvyšuje ich priepustnosť, znižuje tonus arteriol a spôsobuje hypotenziu.
heparín- kyslý mukopolysacharid, obsahuje veľa granúl mastocytov. Uvoľňovanie heparínu zo žírnych buniek a jeho vstup do krvného obehu sa pozoruje u psov s anafylaktickým a peptónovým šokom, ako aj pri injekciách látok, ktoré spôsobujú uvoľňovanie histamínu, do krvi. To spomaľuje zrážanie krvi u psov. U iných zvierat (králiky, morčatá, potkany) sa zrážanlivosť krvi nemení. Účasť heparínu na ľudských alergických reakciách bola málo študovaná.
Acetylcholín- vo voľnom stave a viazaný na tkanivové bielkoviny je obsiahnutý takmer vo všetkých orgánoch. Podieľa sa na mechanizme alergických reakcií najmä tých orgánov a tkanív, kde sa cholinergné reakcie priamo podieľajú na normálnych fyziologických procesoch (napríklad synaptické spojenia autonómneho a centrálneho nervový systém, inervácia srdca, čriev atď.). V procese senzibilizácie sa aktivita cholínesterázy tkanív a krvi mení a s povoľným zavedením alergénu sa zvyšuje uvoľňovanie acetylcholínu z tkanív.
Štádium patofyziologických zmien
Patofyziologické štádium alergických reakcií je konečné vyjadrenie tých imunitných a patochemických procesov, ktoré prebehli po zavedení špecifického alergénu do senzibilizovaného organizmu. Pozostáva z reakcie buniek, tkanív, orgánov a tela ako celku poškodeného alergénom.
Alergické poškodenie jednotlivých buniek dobre preštudované na príklade erytrocytov, krvných doštičiek, krvných leukocytov, buniek spojivového tkaniva - histiocytov, žírnych buniek atď. Poškodenie sa rozširuje na nervové a hladké svalové bunky, srdcový sval atď.
Reakcia každej z poškodených buniek je určená jej fyziologickými vlastnosťami. Takže v nervovej bunke existuje elektrický potenciál poškodenia, v myofibrilách hladkých svalov - kontraktúra; erytrocyty podliehajú hemolýze. Poškodenie leukocytov je vyjadrené v redistribúcii glykogénu v protoplazme, v lýze. Granulované bunky napučiavajú a vyhadzujú svoje granuly - dochádza k degranulácii buniek. Posledný menovaný proces je obzvlášť výrazný v krvných bazofiloch a mastocytoch voľného spojivového tkaniva, ktorých granule sú obzvlášť bohaté na rôzne biologicky aktívne látky, ktoré sprostredkúvajú alergické reakcie (obr. 16).

Alergické poškodenie tkanív a orgánov vzniká v dôsledku poškodenia buniek, ktoré tvoria toto tkanivo, na jednej strane a v dôsledku porušenia nervovej a humorálnej regulácie funkcií týchto orgánov na strane druhej. Kontraktúra hladkých svalov malých priedušiek teda spôsobuje bronchospazmus a zníženie lúmenu dýchacích ciest. Avšak zmena excitability dýchacieho centra a senzorických nervových zakončení blúdivého nervu, v stenách alveol (porušenie Hering-Breuerovho reflexu) a intenzívna sekrécia hlienu, ktorý upcháva lúmen bronchiolov, a expanzných kapilár obklopujúcich alveoly a zvýšenie priepustnosti kapilárnych stien.
Rozšírenie krvných ciev a zvýšenie priepustnosti kapilár, čo vedie k poteniu tekutej časti krvi v tkanive a spôsobuje výskyt žihľavky, Quinckeho edému, závisí jednak od účinku mediátorov alergie (histamín, serotonín) na ciev, ako aj na poruchy periférnej a centrálnej regulácie cievneho tonusu. Všeobecným vyjadrením patofyziologickej fázy alergických reakcií je reakcia organizmu ako celku, niektoré alergické ochorenia alebo alergické syndrómy.