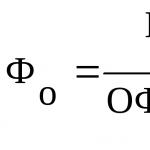Нарушения обмена веществ лежат в основе всех функциональных и органических повреждений органов и тканей, ведущих к возникновению болезни. Вместе с тем, патология обмена веществ может усугублять течение основной болезни, выступая как осложняющий фактор.
Одной из наиболее частых причин общих нарушений белкового обмена является количественная или качественная белковая недостаточность первичного (экзогенного) происхождения. Она может быть обусловлена:
1. нарушением расщепления и всасывания белков в ЖКТ;
2. замедлением поступления аминокислот в органы и ткани;
3. нарушением биосинтеза белка;
4. нарушением межуточного обмена аминокислот;
5. изменением скорости распада белка;
6. патологией образования конечных продуктов белкового обмена.
Нарушения расщепления и всасывания белков . В пищеварительном тракте белки расщепляются под влиянием протеолитических ферментов. При этом, с одной стороны, белковые вещества и другие азотистые соединения, теряют свои специфические особенности.
Основные причины недостаточного расщепления белков - количественное уменьшение секреции соляной кислоты и ферментов, снижение активности протеолитических ферментов (пепсина, трипсина, химотрипсина) и связанное с этим недостаточное образование аминокислот, уменьшение времени их воздействия (ускорение перистальтики).
Помимо общих проявлений нарушения аминокислотного обмена могут быть специфические нарушения, связанные с отсутствием конкретной аминокислоты. Так, недостаток лизина (особенно в развивающемся организме) задерживает рост и общее развитие, понижает содержание в крови гемоглобина и эритроцитов. При недостатке в организме триптофана возникает гипохромная анемия. Дефицит аргинина приводит к нарушению сперматогенеза, а гистидина - к развитию экземы, отставанию в росте, угнетению синтеза гемоглобина.
Кроме того, недостаточное переваривание белка в верхних отделах желудочно-кишечного тракта сопровождается увеличением перехода продуктов его неполного расщепления в толстый кишечник и усилением процесса бактериального расщепления аминокислот. Это ведет к увеличению образования ядовитых ароматических соединений (индол, скатол, фенол, крезол) и развитию общей интоксикации организма этими продуктами гниения.
Замедление поступления аминокислот в органы и ткани. Поскольку ряд аминокислот является исходным материалом при образовании биогенных аминов, задержка их в крови создает условия для накопления в тканях и крови соответствующих протеиногенных аминов и проявления их патогенного действия на различные органы и системы. Увеличенное содержание в крови тирозина способствует накоплению тирамина, который участвует в патогенезе злокачественной гипертонии. Длительное повышение количества гистидина ведет к увеличению концентрации гистамина, что способствует нарушению кровообращения и проницаемости капилляров. Кроме того, увеличение содержания аминокислот в крови проявляется увеличением их выведения с мочой и формированием особой формы нарушений обмена - аминоацидурией. Аминоацидурия может быть общей, связанной с повышением концентрации в крови нескольких аминокислот, или избирательной - при увеличении содержания в крови какой-нибудь одной аминокислоты.
Нарушение синтеза белков . Синтез белковых структур в организме является центральным звеном метаболизма белка. Даже небольшие нарушения специфичности биосинтеза белка могут вести к глубоким патологическим изменениям в организме.
Отсутствие в клетках хотя бы одной (из 20) незаменимой аминокислоты прекращает синтез белка в целом.
Нарушение скорости синтеза белка может быть обусловлено расстройством функции соответствующих генетических структур, на которых совершается этот синтез (транскрипция ДНК, трансляция).
Повреждение генетического аппарата может быть как наследственным, так и приобретенным, возникшим под влиянием различных мутагенных факторов (ионизирующее излучение, ультрафиолетовые лучи и пр.). Нарушение синтеза белка могут вызывать некоторые антибиотики. Так, "ошибки" в считывании генетического кода могут возникнуть под влиянием стрептомицина, неомицина и ряда других антибиотиков. Тетрациклины тормозят присоединение новых аминокислот к растущей полипептидной цепи. Митомицин угнетает синтез белка за счет алкилирования ДНК (образование прочных ковалентных связей между ее цепями), препятствуя расщеплению нитей ДНК.
Выделяют качественные и количественные нарушения биосинтеза белков. О том, какое значение могут иметь качественные изменения биосинтеза белков в патогенезе различных заболеваний, можно судить на примере некоторых видов анемий при появлении патологических гемоглобинов. Замена только одного аминокислотного остатка (глутамина) в молекуле гемоглобина на валин приводит к тяжелому заболеванию - серповидноклеточной анемии.
Особый интерес представляют количественные изменения в биосинтезе белков органов и крови, приводящие к сдвигу соотношений отдельных фракций белков в сыворотке крови - диспротеинемии. Выделяют две формы диспротеинемий: гиперпротеинемия (увеличение содержания всех или отдельных видов белков) и гипопротеинемия (уменьшение содержания всех или отдельных белков). Так, ряд заболеваний печени (цирроз, гепатит), почек (нефрит, нефроз) сопровождаются выраженным уменьшением содержания альбуминов. Ряд инфекционных заболеваний, сопровождающихся обширными воспалительными процессами, ведет к увеличению содержания гамма-глобулинов. Развитие диспротеинемии сопровождается, как правило, серьезными сдвигами в гомеостазе организма (нарушением онкотического давления, водного обмена). Значительное уменьшение синтеза белков, особенно альбуминов и гамма-глобулинов, ведет к резкому снижению сопротивляемости организма к инфекции, снижению иммунологической устойчивости. Значение гипопротеинемии в форме гипоальбуминемии определяется еще и тем, что альбумин образует более или менее прочные комплексы с различными веществами, обеспечивая их транспорт между различными органами и перенос через клеточные мембраны при участии специфических рецепторов. Известно, что соли железа и меди (чрезвычайно токсичные для организма) при pH сыворотки крови трудно растворимы и транспорт их возможен только в виде комплексов со специфическими белками сыворотки (трансферрином и церулоплазмином), что предотвращает интоксикацию этими солями. Около половины кальция удерживается в крови в форме, связанной с альбуминами сыворотки. При этом в крови устанавливается определенное динамическое равновесие между связанной формой кальция и ионизированными его соединениями. При всех заболеваниях, сопровождающихся снижением содержания альбуминов (заболевания почек) ослабляется и способность регулировать концентрацию ионизированного кальция в крови. Кроме того, альбумины являются носителями некоторых компонентов углеводного обмена (глюкопротеиды) и основными переносчиками свободных (неэстерифицированных) жирных кислот, ряда гормонов.
При поражении печени и почек, ряде острых и хронических воспалительных процессов (ревматизме, инфекционном миокарде, пневмонии) в организме начинают синтезироваться особые белки с измененными свойствами или несвойственной норме. Классическим примером болезней, вызванных наличием патологических белков, являются болезни, связанные с присутствием патологического гемоглобина (гемоглобинозы). Нарушения свертывания крови возникают при появлении патологических фибриногенов. К необычным белкам крови относятся криоглобулины, способные выпадать в осадок при температуре ниже 37°C, что ведет к тромбообразованию. Появление их сопровождает нефроз, цирроз печени и другие заболевания.
Патология межуточного белкового обмена (нарушение обмена аминокислот).
Центральное место в межуточном обмене белков занимает реакция переаминирования , как основной источник образования новых аминокислот. Нарушение переаминирования может возникнуть в результате недостаточности в организме витамина B 6 . Это объясняется тем, что фосфорилированная форма витамина B 6 - фосфопиродоксаль является активной группой трансаминаз - специфических ферментов переаминирования между амино - и кетокислотами. Беременность, длительный прием сульфаниламидов тормозят синтез витамина B 6 и могут послужить основой нарушения обмена аминокислот. Наконец, причиной снижения активности переаминирования может послужить угнетение активности трансаминаз вследствие нарушения синтеза этих ферментов (при белковом голодании), либо нарушения регуляции их активности со стороны ряда гормонов.
Процессы переаминирования аминокислот тесно связаны с процессами окислительного дезаминирования , в ходе которого осуществляется ферментативное отщепление аммиака от аминокислот. Дезаминирование определяет как образование конечных продуктов белкового обмена, так и вступление аминокислот в энергетический обмен. Ослабление дезаминирования может возникнуть вследствие нарушения окислительных процессов в тканях (гипоксия, гиповитаминозы C, PP, B 2). Однако, наиболее резкое нарушение дезаминирования наступает при понижении активности аминооксидаз, либо вследствие ослабления их синтеза (диффузное поражение печени, белковая недостаточность), либо в результате относительной недостаточности их активности (увеличение содержания в крови свободных аминокислот). Следствием нарушения окислительного дезаминирования аминокислот будет ослабление мочевинообразования, увеличение концентрации аминокислот и увеличение выведения их с мочой - аминоацидурия.
Межуточный обмен ряда аминокислот совершается не только в форме переаминирования и окислительного дезаминирования, но и путем их декарбоксилирования (потеря CO 2 из карбоксильной группы) с образованием соответствующих аминов, получивших название "биогенные амины". Так, при декарбоксилировании гистидина образуется гистамин, тирозина - тирамин, 5-гидрокситриптофана - серотин и т.д. Все эти амины биологически активны и оказывают выраженное фармакологическое действие на сосуды.
Изменение скорости распада белка . Значительное увеличение скорости распада белков тканей и крови наблюдается при повышении температуры организма, обширных воспалительных процессах, тяжелых травмах, гипоксии, злокачественных опухолях и т.д., что связано либо с действием бактериальных токсинов (в случае инфицирования), либо со значительным увеличением активности протеолитических ферментов крови (при гипоксии), либо токсическим действием продуктов распада тканей (при травмах). В большинстве случаев ускорение распада белков сопровождается развитием в организме отрицательного азотистого баланса в связи с преобладанием процессов распада белков над их биосинтезом.
Патология конечного этапа белкового обмена . Основными конечными продуктами белкового обмена являются аммиак и мочевина. Патология конечного этапа белкового обмена может проявляться нарушением образования конечных продуктов, либо нарушением их выведения.
Основным механизмом связывания аммиака является процесс образования мочевины в цитруллин-аргининорнитиновом цикле. Нарушения образования мочевины могут наступить в результате снижения активности ферментных систем, участвующих в этом процессе (гепатиты, цирроз печени), общей белковой недостаточности. При нарушении мочевинообразования в крови и тканях накапливается аммиак и увеличивается концентрация свободных аминокислот, что сопровождается развитием гиперазотемии. При тяжелых формах гепатитов и цирроза печени, когда резко нарушена ее мочевинообразовательная функция, развивается выраженная аммиачная интоксикация (нарушение функций центральной нервной системы).
В других органах и тканях (мышцы, нервная ткань) аммиак связывается в реакции амидирования с присоединением к карбоксильной группе свободных дикарбоновых аминокислот. Главным субстратом служит глутаминовая кислота.
Другим конечным продуктом белкового обмена, образующимся при окислении креатина (азотистое вещество мышц) является креатинин. При голодании, авитаминозе E, лихорадочных инфекционных заболеваниях, тиреотоксикозе и ряде других заболеваний, креатинурия свидетельствует о нарушении креатинового обмена.
При нарушении выделительной функции почек (нефриты) происходит задержка мочевины и других азотистых продуктов в крови. Остаточный азот увеличивается - развивается гиперазотемия. Крайней степенью нарушения экскреции азотистых метаболитов является уремия.
При одновременном поражении печени и почек возникает нарушение образования и выделения конечных продуктов белкового обмена.
В педиатрической практике особое значение принадлежит наследственным аминоацидопатиям, список которых на сегодня насчитывает около 60 различных нозологических форм. По типу наследования почти все они относятся к аутосомно-рецессивным. Патогенез обусловлен недостаточностью того или иного фермента, осуществляющего катаболизм и анаболизм аминокислот. Общим биохимическим признаком аминоацидопатий служит ацидоз тканей и аминоацидурия. Наиболее частыми наследственными дефектами обмена являются четыре энзимопатии, которые связаны друг с другом общим путем метаболизма аминокислот: фенилкетонурия, тирозинемия, альбинизм, алькаптонурия.
Углеводы составляют обязательную и большую часть пищи человека (около 500 г/сут). Углеводы - наиболее легко мобилизируемый и утилизируемый материал. Они депонируются в виде гликогена, жира. В ходе углеводного обмена образуется НАДФ·H 2 . Особую роль углеводы играют в энергетике центральной нервной системы, так как глюкоза является единственным источником энергии для мозга.
Расстройство обмена углеводов может быть обусловлено нарушением их переваривания и всасывания в пищеварительном тракте. Экзогенные углеводы поступают в организм в виде поли-, ди - и моносахаридов. Их расщепление в основном происходит в двенадцатиперстной кишке и тонком кишечнике, соки которых содержат активные амилолитические ферменты (амилазу, мальтазу, сахаразу, лактазу, инвертазу и др.). Углеводы расщепляются до моносахаридов и всасываются. Если продукция амилолитических ферментов недостаточна, то поступающие с пищей ди - и полисахариды не расщепляются до моносахаридов и не всасываются. Всасывание глюкозы страдает при нарушении ее фосфорилирования в кишечной стенке. В основе данного нарушения лежит недостаточность фермента гексокиназы, развивающаяся при тяжелых воспалительных процессах в кишечнике, при отравлении монойодацетатом, флоридзином. Нефосфорилированная глюкоза не проходит через кишечную стенку и не усваивается. Может развиться углеводное голодание.
Нарушение синтеза и расщепления гликогена . Патологическое усиление распада гликогена происходит при сильном возбуждении ЦНС, при повышении активности гормонов, стимулирующих гликогенолиз (СТГ, адреналин, глюкагон, тироксин). Повышение распада гликогена при одновременном увеличении потребления мышцами глюкозы происходит при тяжелой мышечной нагрузке. Синтез гликогена может изменяться в сторону снижения или патологического усиления.
Снижение синтеза гликогена происходит при тяжелом поражении печеночных клеток (гепатиты, отравление печеночными ядами), когда нарушается их гликогенообразовательная функция. Синтез гликогена снижается при гипоксии, так как в условиях гипоксии уменьшается образование АТФ, необходимой для синтеза гликогена.
Гипергликемия - повышение уровня сахара в крови выше нормального. Может развиваться в физиологических условиях; при этом имеет приспособительное значение, так как обеспечивает доставку тканям энергетического материала. В зависимости от этиологического фактора различают следующие типы гипергликемии.
Алиментарная гипергликемия, развивающаяся после приема большого количества легко усвояемых углеводов (сахар, конфеты, мучные изделия и др.).
Нейрогенная (эмоциональная) гипергликемия - при эмоциональном возбуждении, стрессе, боли, эфирном наркозе.
Гормональные гипергликемии сопровождают нарушения функций эндокринных желез, гормоны которых участвуют в регуляции углеводного обмена.
Гипергликемия при недостаточности гормона инсулина является наиболее выраженной и стойкой. Она может быть панкреатической (абсолютной) и внепанкреатической (относительной).
Панкреатическая недостаточность инсулина развивается при разрушении или повреждении инсулярного аппарата поджелудочной железы. Частой причиной является местная гипоксия островков Лангерганса при атеросклерозе, спазме сосудов. При этом нарушается образование в инсулине дисульфидных связей и инсулин теряет активность - не оказывает гипогликемического эффекта.
К инсулиновой недостаточности может привести разрушение поджелудочной железы опухолями, повреждение ее инфекционным процессом (туберкулез, сифилис). Образование инсулина может нарушиться при панкреатитах - острых воспалительно-дегенеративных процессах в поджелудочной железе.
Инсулярный аппарат перенапрягается и может истощиться при излишнем и частом употреблении в пищу легкоусвояемых углеводов (сахар, конфеты), при переедании, что ведет к алиментарной гипергликемии.
Ряд лекарственных препаратов (группы тиазидов, кортикостероиды и др.) могут вызывать нарушения толерантности к глюкозе, а у предрасположенных к диабету лиц явиться пусковым фактором в развитии данного заболевания.
Внепанкреатическая недостаточность инсулина . Ее причиной может послужить избыточная связь инсулина с переносящими белками крови. Инсулин, связанный с белком, активен лишь в отношении жировой ткани. Он обеспечивает переход глюкозы в жир, тормозит липолиз. При этом развивается так называемый диабет тучных.
При сахарном диабете нарушаются все виды обмена веществ.
Нарушения углеводного обмена определяют характерный симптом диабета - стойкую выраженную гипергликемию. Ее обусловливают следующие особенности углеводного обмена при сахарном диабете: понижение прохождения глюкозы через клеточные мембраны и ассимиляции ее тканями; замедление синтеза гликогена и ускорение его распада; усиление глюконеогенеза - образование глюкозы из лактата, пирувата, аминокислот и других продуктов неуглеводного обмена; торможение перехода глюкозы в жир.
Значение гипергликемии в патогенезе сахарного диабета двояко. Она играет определенную адаптивную роль, так как при ней тормозится распад гликогена и отчасти увеличивается его синтез. Глюкоза легче проникает в ткани, и они не испытывают резкого недостатка углеводов. Гипергликемия имеет и отрицательное значение. При ней резко повышается поступление глюкозы в клетки инсулиннезависимых тканей (хрусталик, клетки печени, бета-клетки островков Лангерганса, нервная ткань, эритроциты, стенка аорты). Избыточная глюкоза не подвергается фосфорилированию, а превращается в сорбитол и фруктозу. Это осмотически активные вещества, нарушающие обмен в данных тканях и вызывающие их повреждение. При гипергликемии повышается концентрация глюко - и мукопротеидов, которые легко выпадают в соединительной ткани, способствую образованию гиалина.
При гипергликемии, превышающей 8 моль/л, глюкоза начинает переходить в окончательную мочу - развивается глюкозурия. Это проявление декомпенсации углеводного обмена.
При сахарном диабете процессы фосфорилирования и дефосфорилирования глюкозы в канальцах не справляются с избытком глюкозы в первичной моче. Кроме того, при диабете снижена активность гексокиназы, поэтому почечный порог для глюкозы снижается по сравнению с нормальным. Развивается глюкозурия. При тяжелых формах сахарного диабета содержание сахара в моче может достигать 8-10%. Осмотическое давление мочи при этом повышается, в связи с чем в окончательную мочу переходит много воды. За сутки выделяется 5-10 л и более мочи (полиурия) с высокой относительной плотностью за счет сахара. В результате полиурии развивается обезвоживание организма, и как следствие его - усиленная жажда (полидипсия).
При очень высоком уровне сахара в крови (30-50 моль/л и выше) резко возрастает осмотическое давление крови. В результате происходит обезвоживание организма. Может развиться гиперосмолярная кома. Состояние больных при ней крайне тяжелое. Сознание отсутствует. Резко выражены признаки обезвоживания тканей (мягкие при пальпации глазные яблоки). При очень высокой гипергликемии уровень кетоновых тел близок к норме. В результате обезвоживания происходит повреждение почек, нарушается их функция вплоть до развития почечной недостаточности.
Патологические изменения в обмене жиров могут возникать на различных его этапах: при нарушении процессов переваривания и всасывания жиров; при нарушении транспорта жира и перехода его в ткани; при нарушении окисления жиров в тканях; при нарушении промежуточного жирового обмена; при нарушении обмена жира в жировой ткани (избыточное или недостаточное его образование и отложение).
Нарушение процесса переваривания и всасывания жиров наблюдается:
1. при недостатке панкреатической липазы,
2. при дефиците желчных кислот (воспаление желчного пузыря, закупорка желчного протока, заболевания печени). Нарушается эмульгирование жира, активация панкреатической липазы и образование наружной оболочки смешанных мицелл, в составе которых высшие жирные кислоты и моноглицериды переносятся с места гидролиза жиров к всасывающей поверхности кишечного эпителия;
3. при усиленной перистальтике тонкого кишечника и поражениях эпителия тонких кишок инфекционными и токсическими агентами
4. при избытке в пище ионов кальция и магния, когда образуются нерастворимые в воде соли желчных кислот - мыла;
5. при авитаминозах A и B, недостатке холина, а также при нарушении процесса фосфорилирования (тормозится всасывание жира).
Как следствие нарушения всасывания жира развивается стеаторея (кал содержит много высших жирных кислот и нерасщепленного жира). Вместе с жиром теряется и кальций.
В синтезе белков на рибосомах микроорганизмов, состоящих из 30S и 50S субъединиц (у человека – 60S и 40S субъединиц; единицы седиментации), различают следующие стадии:
1) инициация – присоединение аминокислот к мРНК с помощью тРНК (триплет антикодона тРНК взаимодействует с кодоном мРНК);
2) элонгация – присоединение тРНК с новой аминокислотой к кодону мРНК в месте А (ацил) рибосомы;
3) транспептидация – присоединение уже образованного пептида из места Р (пептидил) к новой аминокислоте в месте А рибосомы;
4) транслокация – в связи с движением рибосомы по мРНК образовавшийся пептид перемещается из места А в место Р; тРНК отсоединяется (рис. 83).
Рис. 83. Основные этапы синтеза белка на рибосомах.
К антибиотикам, нарушающим синтез белков, относятся аминогликозиды, тетрациклины, хлорамфеникол, макролиды, линкозамиды.
Аминогликозиды нарушают правильное присоединение новой аминокислоты.
Тетрациклины препятствуют соединению антикодона тРНК с кодоном мРНК.
Хлорамфеникол нарушает транспептидацию.
Макролиды и линкозамиды влияют на процессы транслокации и могут конкурировать между собой (при этом их антибактериальное действие ослабляется).
Аминогликозиды
Аминогликозиды – антибиотики широкого спектра действия. Действуют на грамотрицательные и некоторые грамположительные бактерии. Не действуют на метициллин-резистентные стафилококки.
Аминогликозиды плохо проникают через порины клеточной стенки бактерий. Антибиотики (в частности, пенициллины), нарушающие целостность клеточной стенки, облегчают проникновение аминогликозидов в бактериальную клетку.
Через цитоплазматическую мембрану бактерий аминогликозиды проникают путём кислородзависимого активного транспорта (поэтому неэффективны в отношении анаэробных бактерий).
Проникая в цитоплазму бактериальной клетки, аминогликозиды воздействуют на 30-ю субъединицу рибосом. Нарушают начальные этапы синтеза белка на рибосомах бактерий. Аминогликозиды нарушают правильное считывание мРНК. В результате в месте А (рис. 83) присоединяются другие аминокислоты и образуются «неправильные» (нефункциональные) белки, которые оказывают повреждающее влияние на цитоплазматическую мембрану.
В более высоких дозах аминогликозиды нарушают образование полисом. Под влиянием аминогликозидов полисомы разделяются на отдельные рибосомы (моносомы), которые не способны двигаться по мРНК.
Таким образом, при действии аминогликозидов нарушается:
1) проницаемость цитоплазматической мембраны;
2) синтез белков бактерий.
Действие аминогликозидов бактерицидно.
Аминогликозиды – высокополярные соединения (поликатионы). Практически не всасываются в желудочно-кишечном тракте, поэтому вводятся внутримышечно или внутривенно. Не проникают через гематоэнцефалический барьер. Проникают в стекловидное тело глаз. Проникают через плаценту. В высоких концентрациях определяются в секретах желез, плевральной жидкости, в суставах.
Аминогликозиды мало метаболизируются в организме; 50–60 % выделяется почками в неизменённом виде. Это способствует эффективности аминогликозидов при инфекционных заболеваниях почек и мочевыводящих путей. В то же время при почечной недостаточности токсическое действие аминогликозидов (ототоксичность, нефротоксичность) усиливается.
Применяют аминогликозиды в основном при тяжёлых инфекциях, вызыванных чувствительными к аминогликозидам микроорганизмами (сепсис, перитонит, инфекции мочевыводящих путей, пневмонии, раневые и ожоговые инфекции).
Выделяют следующие поколения аминогликозидов:
I поколение – стрептомицин, канамицин, неомицин;
II поколение – гентамицин, тобрамицин;
III поколение – амикацин, нетилмицин.
Стрептомицин (Streptomycin) – первый из открытых антибиотиков, эффективный в отношении микобактерий туберкулёза. За открытие стрептомицина S. A. Waksman (США) в 1952 г. получил Нобелевскую премию. Он же ввёл термин «антибиотик».
Стрептомицин оказался также высокоэффективным лекарственным средством при чуме, туляремии, бруцеллёзе. Эффективен в отношении кокков (пневмококки относительно устойчивы), гемофильной палочки, клебсиелл, шигелл, сальмонелл. Устойчивы к стрептомицину анаэробы, спирохеты, риккетсии, синегнойная палочка. Применяют стрептомицин при туберкулёзе, туляремии, чуме (вместе с доксициклином), бруцеллёзе, а также при пневмониях, хронических осложнённых инфекциях мочевыводящих путей. Вводят внутримышечно или внутривенно.
Канамицин (Kanamycin) применяют при устойчивости микобактерий туберкулёза к стрептомицину.
Неомицин (Neomycin) в связи с более высокой токсичностью применяют только местно. Препарат не всасывается при энтеральном введении и может назначаться внутрь при энтеритах, а также для подавления микробной флоры кишечника перед хирургическими операциями.
Из аминогликозидов II поколения наиболее часто применяют гентамицин.
Гентамицин (Gentamicin) эффективен в отношении стафилококков, энтерококков, кишечной палочки, шигелл, сальмонелл, клебсиелл, протея, палочки туляремии, бруцелл. В отличие от препаратов I поколения, гентамицин и другие препараты II поколения действуют на синегнойную палочку. Устойчивы к гентамицину анаэробные бактерии, менингококки, бледная трепонема, микоплазмы, хламидии, легионеллы. Гентамицин малоэффективен при туберкулёзе. Вводят гентамицин внутримышечно или внутривенно (медленно или капельно; t 1/2 гентамицина – 2–3 ч); 50–60 % неизменённого гентамицина выводится почками.
Применяют гентамицин при пневмониях, абсцессе лёгкого, сепсисе, перитоните, эндокардите, вызванном энтерококками (совместно с бензилпенициллином), остром холецистите и холангите, остром и хроническом пиелонефрите, цистите, простатите, гнойных инфекциях кожи, мягких тканей, костей (остеомиелит), суставов, при раневых и ожоговых инфекциях, вызванных чувствительными к гентамицину микроорганизмами.
Наружно гентамицин применяют при пиодермиях, инфицированных ранах, а также в глазной практике при блефарите, конъюнктивите в виде глазных капель (по 1 капле 4–6 раз в день).
Побочные эффекты гентамицина:
– снижение слуха;
– вестибулярные нарушения;
– тошнота, рвота;
– нарушения функции печени;
– протеинурия, мышечная слабость;
– лейкопения;
– кожные сыпи.
Противопоказан гентамицин при миастении.
Тобрамицин (Tobramycin) сходен по свойствам и применению с гентамицином. Более эффективен в отношении синегнойной палочки. В виде препарата Тобрекс применяется в качестве глазных капель при блефарите, конъюнктивите, кератоконъюнктивите, иридоциклите.
Аминогликозиды III поколения – амикацин, нетилмицин – сходны по спектру действия с гентамицином и тобрамицином. Эффективны в отношении бактерий, устойчивых к аминогликозидам I и II поколений.
Амикацин (Amikacin) – аминогликозид наиболее широкого спектра действия; применяется при неэффективности гентамицина. Эффективен в отношении микобактерий туберкулёза.
Накапливается в межклеточной жидкости, выводится почками с высокой концентрацией в моче. Применяют амикацин при пневмониях, абсцессе лёгких, эндокардитах, инфекциях почек и мочевыводящих путей, остеомиелите, ожоговой инфекции, комплексном лечении туберкулёза. Вводят внутримышечно или внутривенно капельно.
Нетилмицин (Netilmycin) сходен по свойствам с амикацином.
Из других аминогликозидов в медицинской практике применяют сизомицин, паромомицин, фрамицетин.
Сизомицин (Sisomycin) вводят внутримышечно или внутривенно при инфекциях желче- и мочевыводящих путей, при пневмониях, менингите, перитоните, сепсисе, инфекционных артритах, остеомиелите.
Паромомицин (Paromomycin) плохо всасывается в желудочно-кишечном тракте. Назначают внутрь при гастроэнтеритах, энтероколите, сальмонеллёзе, шигеллёзе, амёбиазе, лямблиозе, а также при подготовке к операциям на кишечнике.
Фрамицетин (Framycetin) – препарат для местного применения. В виде спрея для носа применяют при ринитах, ринофарингитах, синуситах.
Побочные эффекты аминогликозидов:
1) нефротоксическое действие (поражение почечных канальцев) при длительном применении (гентамицин > тобрамицин > амикацин = стрептомицин, нетилмицин);
2) ототоксическое действие (необратимые нарушения чувствительных клеток улитки и вестибулярного аппарата):
- нарушения слуха чаще вызывают амикацин, нетилмицин, тобрамицин;
- вестибулярные нарушения (головокружения, атаксия, нарушение равновесия) чаще вызывают амикацин, стрептомицин, гентамицин; ототоксическое действие аминогликозидов значительно усиливается при совместном применении с петлевыми диуретиками (фуросемид и др.), которые также обладают ототоксическими свойствами;
- нарушения нервно-мышечной передачи (препятствуют входу ионов Са 2+ в окончания двигательных нервных волокон при деполяризации пресинаптической мембраны); могут усиливать действие курареподобных средств;
Противопоказаны аминогликозиды при миастении.
Аминоциклитолы
Спектиномицин (Spectinomycin; тробицин) – антибиотик широкого спектра действия. Сходен по химической структуре с аминогликозидами, однако отличается от них по механизму действия. Нарушает синтез белков на стадии транслокации, не влияя (в отличие от аминогликозидов) на правильное считывание кодона мРНК. Действует бактериостатически. Особенно эффективен (действует бактерицидно) в отношении Neisseria gonorrhoeae. Почти полностью (90 %) выводится почками в неизменённом виде.
Применяют спектиномицин только для лечения урогенитальной гонореи у мужчин и женщин. Неосложнённая гонорея (острый уретрит, проктит, цервицит) может быть излечена одной внутримышечной инъекцией спектиномицина.
Стрептограмины
Хинупристин (Quinupristin) и дальфопристин (Dalfopristin) нарушают синтез белков, действуя на 50S субъединицу рибосом и ингибируя пептидилтрансферазу. По отдельности эти препараты малоэффективны, но при совместном применении бактерицидны в отношении грамположительных бактерий, в частности метициллин-резистентных стафилококков, ванкомицин-резистентных энтерококков, стрептококков и стафилококков. Дальфопристин изменяет структуру рибосом, повышая связывание с рибосомами хинупристина.
Комбинированный препарат этих соединений вводят внутривенно при инфекциях, вызванных энтерококками и стафилококками, устойчивыми к ванкомицину. Препарат эффективен при инфекциях, вызванных гемофильной палочкой, моракселлой, микоплазмами, легионеллами, хламидиями. Не действует на синегнойную палочку.
Побочные эффекты:
– флебиты;
– артралгии;
– миалгии.
Тетрациклины
Тетрациклины (содержат в своей химической структуре 4 конденсированных цикла) – антибиотики широкого спектра действия. Нарушают синтез белков на рибосомах бактерий. Действуют на 30S субъединицу рибосом; препятствуют присоединению в месте А транспортной РНК (тРНК) с очередной аминокислотой, нарушая таким образом процесс элонгации. Действие тетрациклинов бактериостатическое.
Тетрациклины хорошо проникают внутрь клеток и действуют на внутриклеточные микроорганизмы – хламидии, легионеллы, микоплазмы, риккетсии.
Тетрациклины (чаще всего доксициклин) – препараты выбора при риккетсиозах (сыпной тиф и др.), бруцеллёзе (совместно с гентамицином или рифампицином), холере, чуме, хламидиозе лёгких и мочеполовой системы, инфекциях, вызванных микоплазмой или уреаплазмой, болезни Лайма (клещевой боррелиоз).
Тетрациклины – препараты резерва при сифилисе, гонорее, сибирской язве, иерсиниозе, шигеллёзе, амёбиазе.
Эффективны в отношении кокков, гемофильной палочки, клебсиелл, легионелл, кишечной палочки, Н. pylori, сальмонелл, возбудителей туляремии, а также плазмодиев малярии.
Не действуют на синегнойную палочку, бактероиды, протей, метициллин-резистентные стафилококки.
Тетрациклины всасываются при назначении внутрь (тетрациклин на 60 %, доксициклин – почти полностью). Молоко, антацидные средства, препараты железа могут задерживать всасывание тетрациклинов, так как тетрациклины образуют хелатные соединения с ионами Са 2+ , Mg 2+ , Al 3+ , Fe 2+ .
В связи с образованием хелатных соединений с ионами Са 2+ тетрациклины депонируются в костной ткани, а также в ткани зубов и могут нарушать их развитие. Тетрациклины нельзя назначать детям до 8 лет, беременным и кормящим женщинам.
Доксициклин (Doxycycline; вибрамицин) назначают внутрь при риккетсиозах (сыпной тиф и др.), инфекциях, вызванных хламидиями (трахома, пситтакоз, урогенитальный хламидиоз), бруцеллёзе, чуме, холере, клещевом боррелиозе (болезнь Лайма), инфекциях дыхательных путей (пневмонии, обострении хронического бронхита), желудочно-кишечного тракта, мочеполовой системы, а также при сибирской язве, малярии в качестве резервного препарата – при сифилисе.
В кишечнике всасывается почти полностью (около 90 %). Длительность действия – 12 ч (назначают 2 раза в сутки). Выводится почками в виде неактивных метаболитов. Препарат вводят также внутривенно.
Побочные эффекты доксициклина:
– диспепсические расстройства;
– головная боль;
– нарушения зрения;
– гепатотоксическое действие;
– фотосенсибилизация кожи;
– кандидамикоз кишечника;
– возможен псевдомембранозный колит.
Тетрациклин (Tetracycline) назначают внутрь по тем же показаниям, что и другие тетрациклины. Длительность действия – 6 ч (назначают 4 раза в сутки). Местно при конъюнктивитах, блефаритах применяют глазную тетрациклиновую мазь (закладывают за веко 2–3 раза в день).
Окситетрациклин (Oxytetracycline) назначают внутрь или внутримышечно при пневмониях, бронхитах, ангинах, холецистите, пиелонефрите, кишечных инфекциях, эндометрите, простатите, а также при риккетсиозах, сифилисе, гонорее, бруцеллёзе. Местно в виде мази окситетрациклин применяют при конъюнктивите, блефарите, трахоме.
Побочные эффекты тетрациклинов:
Тошнота, рвота, глоссит;
Кандидамикоз ротовой полости, кишечника, влагалища (связан с подавлением нормальной микрофлоры);
Нарушения функции печени;
Кожные высыпания, фотосенсибилизация, аллергические реакции;
Возможны нарушения сетчатки глаз, функции костного мозга (анемия, нейтропения).
Тетрациклины депонируются в костной ткани, поэтому в раннем возрасте возможны нарушения развития костной ткани и зубов; тетрациклины не рекомендуют назначать детям до 8 лет, беременным и кормящим женщинам. При длительном применении тетрациклинов возможно угнетение активности макрофагов и снижение иммунитета.
Тетрациклины, нарушая синтез белков бактерий, замедляют их рост и поэтому могут ослаблять действие пенициллинов, которые действуют бактерицидно на растущие бактерии.
Хлорамфеникол
Хлорамфеникол (Chloramphenicol; левомицетин) – антибиотик широкого спектра действия. Нарушает синтез белков на рибосомах бактерий. Действует на 50S субъединицу рибосом; ингибирует пептидилтрансферазу и таким образом препятствует транспептидации – переносу пептидной цепи из места Р в место А для присоединения к новой аминокислоте (рис. 83). На большинство чувствительных микроорганизмов действует бактериостатически.
Высокоэффективен (действует бактерицидно) в отношении менингококков, гемофильной палочки (в том числе резистентной к другим антибиотикам). Эффективен в отношении шигелл, сальмонелл, риккетсий, бруцелл, клостридий, хламидий, микоплазм, стрептококков, стафилококков, не продуцирующих пенициллиназу. Действует на В. fragilis, протей.
Устойчив к хлорамфениколу синегнойная палочка, микобактерии туберкулёза, стафилококки, продуцирующие пенициллиназу.
Назначают хлорамфеникол внутрь (препарат почти полностью всасывается в кишечнике); максимальный эффект через 2 ч; t 1/2 –2 ч.
В тяжёлых случаях хлорамфеникол вводят внутривенно. Хлорамфеникол проникает через гематоэнцефалический барьер; концентрация препарата в спинномозговой жидкости составляет примерно 60 % от концентрации в плазме крови. В печени хлорамфеникол подвергается глюкуронированию под влиянием глюкуронилтрансферазы. Примерно 10 % неизменённого хлорамфеникола выделяется с мочой.
Применяют хлорамфеникол при менингитах в случае невозможности использовать пенициллины, при инфекциях, вызыванных гемофильной палочкой (если нельзя применить цефалоспорины III поколения). До появления фторхинолонов левомицетин был препаратом выбора при лечении брюшного тифа. В настоящее время левомицетин – препарат резерва при брюшном тифе и паратифах, бациллярной дизентерии, сыпном тифе и других риккетсиозах, холере, чуме, бруцеллёзе, туляремии, хламидиозе.
В виде глазных капель раствор хлорамфеникола применяют при конъюнктивитах, блефаритах (по 1 капле 4–6 раз в день).
Применение хлорамфеникола ограничено его угнетающим влиянием на кроветворение в костном мозге (возможны лейкопения, агранулоцитоз, апластическая анемия). Другие побочные эффекты:
Суперинфекции (орофарингеальный кандидамикоз, стафилококковый энтероколит);
Стоматит, глоссит;
Неврит зрительного нерва, энцефалопатия.
Противопоказан хлорамфеникол новорожденным детям в связи с недостаточной в этом возрасте системой глюкуронирования хлорамфеникола; может вызывать у них «серый синдром» – цианоз, нерегулярное дыхание, сосудистый коллапс, рвоту, диарею (жидкий зеленый стул), вздутие живота, гипотермию, пепельно-серый цвет кожи; смертность – 40 %.
Хлорамфеникол ингибирует синтез микросомальных ферментов печени и поэтому может усиливать и удлинять действие лекарственных веществ, которые инактивируются этими ферментами. Так, хлорамфеникол увеличивает период полуэлиминации варфарина, фенитоина.
Хлорамфеникол, нарушая синтез белков бактерий, замедляет их рост и поэтому может ослаблять действие пенициллинов, которые действуют бактерицидно на растущие бактерии.
Макролиды
Макролиды – макроциклические соединения. К 14-членным макролидам относятся эритромицин и кларитромицин, к 15-членным – азитромицин (относится к азалидам), к 16-членным – джосамицин, спирамицин.
Макролиды действуют на 50S субъединицу рибосом и нарушают транслокацию – конечный этап синтеза белков на рибосомах бактерий (перемещение образованного пептида из места А в место Р в связи с движением рибосомы по мРНК – рис. 83). Могут конкурировать с линкозамидами за связывание с рибосомами; при этом действие антибиотиков взаимно ослабляется. Поэтому применять макролиды совместно с линкозамидами не рекомендуется.
На большую часть чувствительных микроорганизмов макролиды действуют бактериостатически, на некоторые – бактерицидно. Хорошо проникают в клетки организма, заражённые бактериями. Концентрации макролидов в клетках значительно превосходят их концентрации в плазме крови.
Макролиды эффективны в отношении ряда внутриклеточных возбудителей инфекций (хламидии, микоплазмы, уреаплазмы, легионеллы). Действуют на кокки, гемофильную палочку, палочки дифтерии и сибирской язвы, боррелии, бледную трепонему, Н. pylori.
Макролиды не проникают через гематоэнцефалический барьер, в синовиальную жидкость.
К макролидам устойчивы кишечная палочка, шигеллы, сальмонеллы, синегнойная палочка, клебсиеллы, возбудители чумы, туляремии, В. fragilis, метициллин-резистентные стафилококки.
Применяют макролиды при инфекциях ЛОР-органов, пневмониях, вызыванных хламидиями, микоплазмами, легионеллами, при инфекциях мочевыводящих путей, кожи и мягких тканей.
Рокситромицин и кларитромицин назначают при язвенной болезни желудка и двенадцатиперстной кишки для эрадикации Н. pylori.
Азитромицин высокоэффективен при уретральном хламидиозе.
Эритромицин (Erythromycin) оказывает бактерицидное действие в отношении стрептококков, пневмококков, бактериостатическое – в отношении стафилококков, гонококков, менингококков, гемофильной палочки, хламидий, микоплазм, легионелл, бледной трепонемы. К эритромицину устойчивы кишечная палочка, шигеллы, сальмонеллы, синегнойная палочка.
Препарат всасывается при назначении внутрь, однако биодоступность препарата низкая (35 %). Распределяется в тканях (кроме ЦНС); проникает в предстательную железу и через плаценту. Как и другие макролиды, эритромицин хорошо проникает внутрь клеток тканей; концентрация препарата в клетках примерно в 13 раз выше, чем его концентрация в плазме крови. Концентрируется в печени, выделяется в основном с желчью. Период полуэлиминации (t 1/2) – 90 мин. Продолжительность действия – 6 ч.
Эритромицин – препарат выбора при инфекциях дыхательных путей, вызванных внутриклеточными возбудителями (хламидии, микоплазмы, легионеллы), пневмококками, стрептококками, при инфециях мочеполовых путей (простатит, эпидидимит, цервицит, уретрит), вызыванных хламидиями, уреаплазмами. Применяют эритромицин при пневмониях, ЛОР-инфекциях, болезни легионеров, трахоме, коклюше, дифтерии; в качестве резервного препарата – при скарлатине, бруцеллёзе, гонорее, сифилисе.
Назначают эритромицин внутрь 4 раза в сутки. В виде глазной мази применяют при конъюнктивитах, блефаритах (закладывают за веко 2 раза в день). Возможно внутримышечное введение эритромицина.
Побочные эффекты эритромицина:
– эпигастральный дистресс;
– тошнота, рвота, диарея;
– транзиторное снижение слуха;
– холестатическая желтуха;
– оппортунистические инфекции кишечника.
Кларитромицин (Clarithromycin; клацид) – 6-метокси-эритромицин. По сравнению с эритромицином, более эффективен в отношении гемофильной палочки. Создает более высокие внутриклеточные концентрации и более эффективен в отношении хламидий, легионелл, моракселл, микоплазм, а также возбудителя болезни Лайма (Borrelia burgdorferi). Действует на пневмококки, стрептококки, гонококки, гемофильную палочку, моракселлы, Н. pylori. Хорошо проникает в макрофаги, нейтрофилы. Выделяется с мочой (40 %) в виде метаболитов.
Назначают кларитромицин внутрь или внутривенно 2 раза в сутки (t 1/2 – 4–5 ч) при инфекциях верхних и нижних отделов дыхательных путей, а также при инфекциях кожи и мягких тканей.
Побочные эффекты кларитромицина:
– тошнота;
– диарея;
– дозозависимая глухота.
Рокситромицин (Roxithromycin; рулид) назначают внутрь 1–2 раза в сутки при тонзиллите, фарингите, синусите, среднем отите, инфекциях полости рта, бронхитах, пневмониях, инфекциях мочеполовой системы, вызванных хламидиями, уреаплазмой, при инфекциях кожи (рожа, фурункулы, пиодермия), а также при дифтерии, коклюше. Урогенитальный хламидиоз излечивают рокситромицином в 100 % случаев. Концентрации рокситромицина в нейтрофилах и макрофагах выше, чем в плазме, соответственно в 34 и 16 раз.
Азитромицин (Azithromycin; сумамед) – азалид (включение нитро- (азо-) группы в макролидный цикл). По сравнению с эритромицином, менее эффективен в отношении стафилококков, однако имеет более широкий спектр противомикробного действия. Более эффективен в отношении гемофильной палочки, легионелл. Высокоэффективен в отношении токсоплазм. Эффективен в отношении пневмококков, гонококков, моракселл, хламидий, микоплазм, уреаплазм, бледной трепонемы, Н. pylori, возбудителей коклюша (Bordetella pertussis), газовой гангрены, болезни Лайма (Borrelia burgdoferi). Концентрация азитромицина в фагоцитах в 40 раз выше его концентрации в крови. Азитромицин выделяется в активной форме с желчью.
Назначают азитромицин внутрь 1 раз в сутки (t 1/2 – 48 ч) при инфекциях верхних дыхательных путей и ЛОР-инфекциях (ангина, тонзиллит, синусит, средний отит), инфекциях нижних дыхательных путей (бронхиты, пневмонии), вызванных пневмококками, гемофильной палочкой, хламидиями, микоплазмами, при скарлатине, болезни Лайма, уретрите, вызванном хламидиями, микоплазмами, уреаплазмами, цервиците, гонорее, инфекциях кожи и мягких тканей, для эрадикации Н. pylori.
Побочные эффекты азитромицина:
– тошнота;
– диарея;
– дозозависимая глухота.
Противопоказан азитромицин при беременности, лактации, детям до 12 лет, при тяжёлых нарушениях функции печени, почек.
Мидекамицин (Midecamycin; макропен) назначают внутрь при инфекциях дыхательных и мочеполовых путей, вызванных внутриклеточными возбудителями (хламидии, моракселлы, микоплазмы, уреаплазмы, легионеллы), а также при стрептококковой, стафилококковой инфекции, для лечения и профилактики дифтерии и коклюша, при инфекциях желудочно-кишечного тракта, вызванных Campylobacter spp. Препарат эффективен в отношении Н. pylori.
Спирамицин (Spiramycin; ровамицин) обратимо связывается с 50S субъединицей рибосом и нарушает синтез белков. Оказывает бактериостатическое действие. Назначают спирамицин внутрь или внутривенно при пневмониях, вызыванных хламидиями, легионеллами, микоплазмами, при обострениях хронического бронхита, заболеваниях ЛОР-органов (тонзиллит, синусит, отит), инфекциях мочеполовой системы (в том числе при хламидиозе), инфекционных артритах, остеомиелите, инфекциях кожи и мягких тканей. Джосамицин (Josamycin; вильпрафен) назначают внутрь. Эффективен в отношении Chlamidia trachomatis, Chlamidia pneumoniae, Mycoplasma pneumoniae, Ureaplasma urealyticum, Legionella pneumophila, Treponema pallidum, а также в отношении стрептококков, пневмококков, стафилококков, гонококков, менингококков, палочки дифтерии, возбудителя газовой гангрены. Особенно в высоких концентрациях определяется в ткани лёгких.
Применяют джосамицин при инфекциях дыхательных путей и ЛОР-органов (фарингит, тонзиллит, ларингит, синусит, средний отит), при дифтерии (дополнительно к лечению дифтерийным анатоксином), при хламидийных, уреаплазменных инфекциях мочеполовой системы, а также при сифилисе в случаях невозможности применения препаратов бензилпенициллина.
Линкозамиды
Линкозамиды сходны по механизму действия с макролидами. Действуют на 50S субъединицу хромосом, нарушают процесс транслокации. Действуют преимущественно на грамположительные микроорганизмы в основном бактериостатически. Эффективны в отношении аэробных грамположительных бактерий – стафилококков (в том числе продуцирующих пенициллиназу), стрептококков, пневмококков, а также в отношении клостридий, микоплазм. Эффективны в отношении анаэробных возбудителей (особенно Bacteroides fragilis). Резистентность бактерий к линкозамидам вырабатывается медленно. Линкозамиды хорошо проникают в костную ткань. Не проникают через гематоэнцефалический барьер.
Устойчивы к линкозамидам метициллин-резистентные стафилококки, большинство грамотрицательных бактерий, грибы, вирусы, простейшие.
Линкомицин (Lincomycin) эффективен в отношении грамположительных кокков, в том числе стафилококков, продуцирующих пенициллиназу. Высокоэффективен в отношении бактероидов. Малоактивен в отношении менингококков и гонококков. Не действует линкомицин на кишечную палочку, шигеллы, сальмонеллы, клебсиеллы, легионеллы, синегнойную палочку, хламидии. Устойчивы к линкомицину трихомонады, грибы Candida.
В желудочно-кишечном тракте линкомицин всасывается неполностью – 25–40 %. Депонирутся в высокой концентрации в костной ткани. Выводится с желчью и мочой. Назначают линкомицин внутрь, внутримышечно, внутривенно и местно в виде мази.
Показания к применению линкомицина – сепсис, остеомиелит, инфекционные заболевания челюстей, септический эндокардит, пневмонии, абсцесс лёгкого, рожистое воспаление, отиты.
Побочные эффекты линкомицина:
– тошнота, рвота;
– глоссит, стоматит;
– диарея;
– нарушения функции печени;
– кожные высыпания;
– нейтропения, тромбоцитопения.
При назначении линкомицина внутрь возможен кандидамикоз кишечника и псевдомембранозный колит (вызывается Clostridium difficile), связанные с подавлением нормальной микрофлоры кишечника (при диарее приём препарата следует прекратить). Для лечения псевдомембранозного колита применяют метронидазол, ванкомицин.
В связи с выраженными побочными эффектами линкомицин всё чаще заменяют менее токсичным клиндамицином.
Клиндамицин (Clindamycin; далацин С) – производное линкомицина; в 2–10 раз более активен. На грамположительные кокки действует бактерицидно, на бактроиды – бактериостатически. При назначении внутрь всасывается 90 % препарата. Продолжительность действия клиндамицина – 6 ч. Выделяется почками и с желчью (10 % в неизменённом виде). По сравнению с линкомицином меньше раздражает желудочно-кишечный тракт, реже вызывает псевдомембранозный колит и другие побочные эффекты.
Назначают клиндамицин внутрь 4 раза в сутки при септическом эндокардите, инфекционных заболеваниях ЛОР-органов, костной ткани, суставов, флегмонах челюсти, органов брюшной полости, вызванных чувствительными микроорганизмами. При септицемии, пневмонии, абсцессе лёгких, перитоните препарат вводят внутримышечно или внутривенно капельно. При стафилококковом конъюнктивите клиндамицин назначают в виде глазных капель. При гнойно-воспалительных заболеваниях кожи наружно применяют гель с клиндамицином; при вагинальных инфекциях – вагинальный крем.
Белки органов и тканей нуждаются в постоянном обновлении. Нарушения динамического равновесия катаболизма и анаболизма могут приводить к развитию патологических процессов.
Синтез белка происходит в цитоплазме клеток на рибосомах. Начальным этапом синтеза белков явл. активация аминокислот под воздействием фермента и АТФ с образованием аминоациладенилатов. Активированная аминокислота вступает во взаимодействие с транспортной РНК, данный комплекс подтягивается к рибосоме. Рибосомы в сою очередь вступают в контакт с информационной РНК и, продвигаясь вдоль линейной структуры и-РНК, включают аминокислоты в определенной последовательности. После завершения синтеза полипептидная цепь снимается с рибосомы в окружающую среду, окончательно принимая пространственную конфигурацию, типичную для данного специфического белка. В регуляции синтеза белка принимают участие ген-оператор и регулирующий ген. Регулирующий ген ведает синтезом репрессора, который является ферментом и тормозит деятельность структурных генов. Репрессор взаимодействует с геном-оператором, который составляет единое целое со структурными генами. Репрессор может быть в активном и неактивном состоянии. Активный репрессор подавляет ген-оператор и синтез белка на структурных генах прекращается. Активатором репрессора может быть определенная концентрация белка в клетке. При недостатке белка репрессор заторможен и синтез белка в структурных генах увеличивается. Анаболические гормоны, канцерогенные в-ва тормозят репрессор.
Причины нарушения синтеза белка в клетке:
1. снижение кислорода в атмосферном воздухе и крови;
2. недостаток выработки АТФ.
3. недостаточное содержание белков и незаменимых аминокислот в пище (например, при недостатке триптофана – развивается гипопротеинемия, аргинина - снижается сперматогенез, метионина – развивается жировая инфильтрация печени, валина – возникают мышечная слабость, задержка роста, похудение и развитие кератозов);
4. недостаток анаболических гормонов.
5. нарушение деятельности структурных генов (мутации) (например, если вместо глутаминовой кислоты в молекулу гемоглобина включается валин, то развивается серповидноклеточная анемия);
6. нарушения отдельных этапов биосинтеза белков: репликации, транскрипции и трансляции.
7. при связывании репрессора (например, при блокировании его канцерогенными веществами возникает беспрерывный синтез белка);
8. при нарушении нейроэндокринной регуляции (например, при перерезке нервов и недостатке анаболических гормонов уменьшается выработка белка и изменяется его качество).
Гормоны, регулирующие белковый обмен, делятся на анаболические и катаболические . К анаболическим гормонам относятся соматотропные и гонадотропные гормоны передней доли гипофиза, гормоны половых желез, инсулин. Гормоны щитовидной железы в физиологических дозах в растущем организме стимулируют синтез белка, морфологическую и функциональную дифференцировку тканей. Нормальные дозы в условиях взрослого организма при достаточном и усиленном белковом питании проявляют катаболический эффект, который не приводит к нарушению азотистого равновесия и способствует выведению избытка белка. Гиперпродукция тиреоидных гормонов и глюкокортикоидов оказывает катаболическое действие.
Кроме приобретенных существуют наследственные дефекты биосинтеза белка (нарушения образования факторов свертывания крови, гемоглобина, структурных белков в организме).
Причины усиленного распада белка:
1. избыточное поступление катаболических гомонов, которые активируют внутриклеточные протеиназы, локализованные в лизосомах;
2. повышение проницаемости лизосом под воздействием бактериальных токсинов, продуктов распада тканей, ацидоза, гипоксии и др. факторов, что способствует выделению катепсинов и усилению катаболических процессов.
Среди причин, вызывающих нарушения синтеза белка, важное место занимают различные виды алиментарной недостаточности (полное, неполное голодание, отсутствие в пище незаменимых аминокислот, нарушение определенного количественного соотношения между незаменимыми аминокислотами, поступающими в организм).
Если, например, в тканевом белке триптофан, лизин, валин содержатся в равных соотношениях (1:1:1), а с пищевым белком эти аминокислоты поступают в соотношении 1:1:0,5, то синтез тканевого белка будет обеспечиваться при этом ровно наполовину. Отсутствие в клетках хотя бы одной (из 20) незаменимой аминокислоты прекращает синтез белка в целом.
Нарушение скорости синтеза белка может быть обусловлено расстройством функции соответствующих генетических структур. Повреждение генетического аппарата может быть как наследственным, так и приобретенным, возникшим под влиянием различных мутагенных факторов (ионизирующее излучение, ультрафиолетовые лучи и пр.). Нарушение синтеза белка вызывают некоторые антибиотики. Так, «ошибки» в считывании генетического кода могут возникнуть под влиянием стрептомицина, неомицина и других антибиотиков. Тетрациклины тормозят присоединение новых аминокислот к растущей полипептидной цепи (образование прочных ковалентных связей между ее цепями), препятствуя расщеплению нитей ДНК.
Одной из важных причин, вызывающих нарушение синтеза белка, может быть нарушение регуляции этого процесса. Регуляция интенсивности и направленности белкового обмена контролируется нервной и эндокринной системами, эффекты которых реализуются путем влияния на различные ферментные системы. Децебрация животных ведет к сни-
жению синтеза белка. Соматотропний гормон, половые гормоны и инсулин при определенных условиях стимулируют синтез белка. Наконец, причиной его патологии может стать изменение активности ферментных систем клеток, участвующих в синтезе белка.
Результатом действия этих факторов является уменьшение скорости синтеза отдельных белков.
Количественные изменения в синтезе белков могут приводить к изменению соотношения отдельных фракций белков в сыворотке крови - диспротеинемии. Выделяют две формы диспротеинемии: гиперпро- теинемию (увеличение содержания всех или отдельных видов белков) и гипопротеинемию (уменьшение содержания всех или отдельных белков). Так, некоторые заболевания печени (цирроз, гепатит), почек(нефрит, нефроз) сопровождаются уменьшением синтеза альбумина и уменьшением его содержания в сыворотке. Ряд инфекционных заболеваний, сопровождающихся обширными воспалительными процессами, ведет к увеличению синтеза и последующему повышению содержания гамма-глобулинов в сыворотке. Развитие диспротеинемии сопровождается, как правило, сдвигами в гомеостазе (нарушение онкотического давления, водного баланса). Значительное уменьшение синтеза белков, особенно альбуминов и гамма-глобулинов, ведет к резкому снижению сопротивляемости организма к инфекции.
При поражении печени и почек, некоторых острых и хронических воспалительных процессах (ревматизм, инфекционный миокардит, пневмония) возникают качественные изменения в синтезе белков, при этом синтезируются особые белки с измененными свойствами, например С-ре- активный белок. Примерами болезней, вызванных наличием патологических белков, являются болезни, связанные с присутствием патологического гемоглобина (гемоглобинозы), нарушение свертывания крови при появлении патологических фибриногенов. К необычным белкам крови относятся криоглобулины, способные выпадать в осадок при температуре ниже 37° С (системные болезни, цирроз печени).
Среди причин, вызывающих нарушения синтеза белка, важное место занимают различные виды алиментарной недостаточности (полное, неполное голодание, отсутствие в пище незаменимых аминокислот, нарушение определенного количественного соотношения между незаменимыми аминокислотами, поступающими в организм). Если, например, в тканевом белке триптофан, лизин, валин содержатся в равных соотношениях (1:1:1), а с пищевым белком эти аминокислоты поступают в соотношении 1:1:0,5, то синтез тканевого белка будет обеспечиваться при этом ровно наполовину. Отсутствие в клетках хотя бы одной (из 20) незаменимой аминокислоты прекращает синтез белка в целом.
Нарушение скорости синтеза белка может быть обусловлено расстройством функции соответствующих генетических структур. Повреждение генетического аппарата может быть как наследственным, так и приобретенным, возникшим под влиянием различных мутагенных факторов (ионизирующее излучение, ультрафиолетовые лучи и пр.). Нарушение синтеза белка вызывают некоторые антибиотики. Так, «ошибки» в считывании генетического кода могут возникнуть под влиянием стрептомицина, неомицина и других антибиотиков. Тетрациклины тормозят присоединение новых аминокислот к растущей полипептидной цепи (образование прочных ковалентных связей между ее цепями), препятствуя расщеплению нитей ДНК.
Одной из важных причин, вызывающих нарушение синтеза белка, может быть нарушение регуляции этого процесса. Регуляция интенсивности и направленности белкового обмена контролируется нервной и эндокринной системами, эффекты которых реализуются путем влияния на различные ферментные системы. Децебрация животных ведет к снижению синтеза белка. Соматотропный гормон, половые гормоны и инсулин при определенных условиях стимулируют синтез белка. Наконец, причиной его патологии может стать изменение активности ферментных систем клеток, участвующих в синтезе белка.
Результатом действия этих факторов является уменьшение скорости синтеза отдельных белков.
Количественные изменения в синтезе белков могут приводить к изменению соотношения отдельных фракций белков в сыворотке крови - диспротеинемии. Выделяют две формы диспротеинемии: гиперпротеинемию (увеличение содержания всех или отдельных видов белков) и гипопротеинемию (уменьшение содержания всех или отдельных белков). Так, некоторые заболевания печени (цирроз, гепатит), почек(нефрит, нефроз) сопровождаются уменьшением синтеза альбумина и уменьшением его содержания в сыворотке. Ряд инфекционных заболеваний, сопровождающихся обширными воспалительными процессами, ведет к увеличению синтеза и последующему повышению содержания гамма-глобулинов в сыворотке. Развитие диспротеинемии сопровождается, как правило, сдвигами в гомеостазе (нарушение онкотического давления, водного баланса). Значительное уменьшение синтеза белков, особенно альбуминов и гамма-глобулинов, ведет к резкому снижению сопротивляемости организма к инфекции.
При поражении печени и почек, некоторых острых и хронических воспалительных процессах (ревматизм, инфекционный миокардит, пневмония) возникают качественные изменения в синтезе белков, при этом синтезируются особые белки с измененными свойствами, например С-реактивный белок. Примерами болезней, вызванных наличием патологических белков, являются болезни, связанные с присутствием патологического гемоглобина (гемоглобинозы), нарушение свертывания крови при появлении патологических фибриногенов. К необычным белкам крови относятся криоглобулины, способные выпадать в осадок при температуре ниже 37° С (системные болезни, цирроз печени).
Еще по теме Нарушение синтеза белков:
- ГЕМОЛИТИЧЕСКИЕ АНЕМИИ, ОБУСЛОВЛЕННЫЕ НАРУШЕНИЕМ СИНТЕЗА ГЕМОГЛОБИНА
- Наследственные гемолитические анемии, связанные с нарушением структуры или синтеза гемоглобина (гемоглобинопатии)