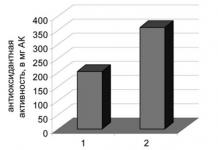
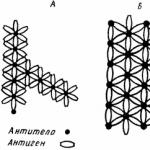
Антитела - протеини на фракцията на глобулиновите кръвни серума и топлокръвни животни, което води до отговор на въвеждането в тялото на различни антигени (бактерии, вируси, протеинови токсини и др.) и специфично взаимодействие с антигените, които причиняват тяхното образование. Чрез свързване към активни места (центрове) с бактерии или вируси, антителата предотвратяват тяхното възпроизвеждане или неутрализират токсичните вещества, освободени от тях. Наличието на антитела в кръвта показва, че тялото е взело под внимание при антиген срещу причиненото от него заболяване. До каква степен имунитетът зависи от антителата и до каква степен антителата само придружават имунитета, по отношение на определено заболяване. Определянето на нивото на антитела в кръвния серум ви позволява да прецените интензивността на имунитета дори в случаите, когато антителата не играят решаваща защитна роля.
Защитният ефект на антитела, съдържащи се в имунния серум, се използва широко в терапията и предотвратяването на инфекциозни заболявания (виж серуфилаксия, серотерапия). Реакциите на антигенните антитяло (серологични реакции) се използват в диагностицирането на различни заболявания (виж серологични проучвания).
История
Дълго време за Chem. Природата А. знаеше много малко. Известно е, че антителата след въвеждането на антигена се намират в серум, лимфа, тъкански екстракти и че те специфично реагират с антигена. Наличието на антитела е изпробвано въз основа на тези видими агрегати, които се образуват, когато взаимодействат с антиген (аглутинация, утаяване) или чрез смяна на свойствата на антигена (неутрализиране на токсин, клетъчен лизис), но с които химически субстратни антитела са свързани, почти нищо не е било известно.
Благодарение на използването на методи за ултрацентрофугиране, имуно-електрофореза и протеинова мобилност в изоелектричното поле, антителата се доказват в класа гамабулини или имуноглобулини.
Антителата са нормални глобулини, които се извършват в процеса на синтез. Имунните глобулини, получени в резултат на имунизация на различни животни със същия антиген и в имунизацията на същия тип животно с различни антигени, притежават неравностойни свойства, както и серумни глобулини на различни видове животни.
Класове на имуноглобулин
Имуноглобулините се произвеждат чрез имунокомпетентни клетки на лимфоидни органи, различават се от себе си. Тегло, постоянна утаяване, електрофоретична мобилност, съдържание на въглехидрати и имунологична активност. Има пет класа (или типове) имуноглобулини:
Имуноглобулини m (IgM): Молекулно тегло от около 1 милион, имат сложна молекула; Първото се появява след имунизацията или антигенната стимулация, имат разрушителен ефект върху микробите, които са попаднали в кръвта, допринасят за тяхната фагоцитоза; по-слаби от имуноглобулините G са свързващи разтворими антигени, токсини на бактерии; Тялото е унищожено в тялото 6 пъти по-бързо от имуноглобулините G (например при плъхове полуживот на имуноглобулин М е 18 часа, и имуноглобулин G - 6 дни).
Имуноглобулини G (IgG): Молекулното тегло е около 160,000, те се считат за стандартни или класически, антитела: лесно преминават през плацентата; са формирани по-бавно от IgM; Най-ефективно свързващите разтворими антигени, особено екзотоксини, както и вируси.
Имуноглобулини А (IgA): Молекулното тегло е около 160,000 или повече, произвеждано от лимфоидна тъкан на лигавиците, предотвратяване на разграждането на ензимите на организма клетките и се сблъсква с патогенния ефект на чревните микроби, лесно прониква през клетъчните бариери на тялото, се съдържат в Коластра, слюнка, сълзи, чревна слуз, пот, разделени от носа, в кръвта са в по-малко, лесно свързани с клетките на тялото; ИГА се появи, очевидно, в процеса на еволюция за защита на лигавиците от агресията от бактерии и прехвърлянето на пасивен имунитет до потомство.
Имуноглобулини Е (IgE): Молекулно тегло от около 190,000 (съгласно R. S. nezlin, 1972); Очевидно те са алергични антитела - така наречените реакции (виж по-долу).
Имуноглобулини D (igd): молекулно тегло от около 180 000 (съгласно R. S. nezlin, 1972); В момента времето е известно много малко за тях.
Структура на антитялото
Имуноглобулин молекулата се състои от две неидентични полипептидни субединици - бели дробове (L - от английски светлина) вериги с молекулно тегло 20,000 и два тежки (Н - от английски тежки) вериги с молекулно тегло 60,000. Тези вериги, свързани с дисулфидни мостове, образуват се Главен мономер LH. Въпреки това, в свободно състояние, такива мономери не са намерени. Повечето от имуноглобулиновите молекули се състоят от димери (LH) 2, оставащите - от полимери (LH) 2N. Основните N-крайни аминокиселини на човешки гамабулин са аспартични и глутами, заек-аланин и аспарагинова киселина. Портър (RR Porter, 1959), засягащ имуноглобулините от папаин, установява, че те се разпадат в два (I и II) Fab фрагмента и Fc фрагмент (III) с кондензацията на утаяване 3.5s и молекулно тегло от около 50,000. Свързани с около 50 000 души. с Fc фрагмента. При предложението на експерти, който има следната номенклатура на фрагментите на антитялото: Fab фрагментът е моновалентен, активно се свързва с антигена; Fc фрагмент - не взаимодейства с антигена и се състои от С-крайни половинки от тежки вериги; FD-Frag-Cop - сюжет от тежка верига, включена в Fab фрагмента. Предлага се 5S фрагмент на пепсиничната хидролиза, за да се обозначи като F (ab) 2 и моновалентен 3,5S фрагмент - Fab.
Специфичност на антителата
Една от най-важните свойства на антителата е тяхната специфичност, която е изразена във факта, че антителата са по-активни и напълно взаимодействат с антигена, към който е стимулиран тялото. Антигенният комплекс е антитялото в този случай притежава най-голяма сила. Антителата могат да разграничат незначителни промени в структурата в антигена. Когато се използва конюгиран антиген, състоящ се от протеин и прост химикал - gaptain, образувани от антитела са специфични за хаптен, протеинов и протеин комплекс - Hapten. Специфичността се дължи на химичната структура и пространствения модел на антидантермански антитела (активни центрове, струйни групи), т.е. областите на антителата, които се свързват с детерминантите на антигена. Броят на антитиминмин на антитела често се нарича тяхната валентност. Така молекулата на IgM антитяло може да има до 10 валци, молекулите IgG и IgA антитяло са двувалентни.
Според Караша (F. Karush, 1962), активните IgG центрове се състоят от 10-20 аминокиселинни остатъка, което е приблизително 1% от всички аминокиселини на молекулата на антитялото, и според представянията на Winkler (MN Winkler, 1963) , активните центрове се състоят от 3-4 аминокиселинни остатъка. Тирозин, лизин, триптофан и други са открити в техния състав, а други. AntberMannants се намират, очевидно, в амино-терминални половини на Fab фрагменти. Променливите сегменти на белите дробове и тежките вериги участват във формирането на активния център, а последният принадлежи към основната роля. Може би лека верига само частично участва в образуването на активен център или стабилизира структурата на тежките вериги. Най-пълният антидаленерман е създаден само от комбинация от белия дроб и тежки вериги. Колкото повече съвпадат с съвпадението на връзката между антиденсеменните антитела и детерминантите на антигена, толкова по-висока е спецификата. Различната специфичност зависи от последователността на аминокиселинните остатъци в активния център на антитела. Кодирането на огромно разнообразие от антитела в тяхната специфичност е неясно. Портър признава три способности на спецификата.
1. Образуването на стабилна част от имуноглобулиновата молекула се наблюдава от един ген и променливата част е хиляди гени. Синтезираните пептидни вериги са свързани в имуноглобулинова молекула под влиянието на специален клетъчен фактор. Антигенът в този случай действа като фактор, който управлява синтеза на антитела.
2. Имуноглобулин молекулата е кодирана със стабилни и променливи гени. По време на клетъчното разделение възниква рекомбинация на променливи гени, която определя разнообразието на тяхната и вариабилност на парцелите на глобулиновите молекули.
3. Генът, кодиращ променливата част на имуноглобулиновата молекула, е повреден от специален ензим. Други ензими възстановяват повреда, но поради грешки позволяват различни последователности на нуклеотиди в този ген. Това води до различна последователност от аминокиселини в променливата част на имуноглобулиновата молекула. Например има и други хипотези. Berenet (F. M. Burnet, 1971).
Хетерогенността (хетерогенност) на антитела се проявява в много термини. В отговор на въвеждането на един антиген, антитела, различаващи се в афинитета на антигена, антигенни детерминанти, молекулно тегло, електрофоретична мобилност, N-крайни аминокиселини. Груповите антитела към различни микроби причиняват кръстосани реакции към различни видове и видове салмонел, шигал, ешеридия, животински протеини, полизахариди. Произведените антитела са нехомогенни при тяхната специфичност по отношение на хомогенен антиген или един антигенни детерминанти. Хетерогенността на антитяло се отбелязва не само срещу протеини и полизахаридни антигени, но и срещу сложни, включително конюгирани, антигени и антигени. Смята се, че хетерогенността на антителата се определя от добре познатия микрохетерогенност на антигена. Хетерогенността може да бъде причинена от образуването на антитела към комплекса на антиген-антитялото, който се наблюдава при многократна имунизация, разлики в клетки, образуващи антитела, както и антитяло към различните имуноглобулинови класове, които, като други протеини, имат сложен антигенен структура, контролирана от генетично.
Типове антитела.
Пълни антитела имат най-малко два активни центъра и когато са свързани с in vitro антигени причиняват видими реакции: аглутинация, валежи, свързване; Неутрализират токсините, вирусите, общат бактерии, определят визуалното явление на имунната залепване, имобилизация, подуване капсули, натоварване на тромбоцитите. Реакциите текат в две фази: специфично (взаимодействие на антитяло с антиген) и неспецифично (един или друг от горните явления). Обикновено се признава, че различни серологични реакции се определят от един, а не много антитела и зависят от методите за формулиране. Има термични пълни антитела, които взаимодействат с антиген при Т ° 37 °, и студ (криофилен), показващ ефект при Т ° под 37 °. Има и антитела, реагиращи с антиген при ниска температура и видимият ефект се проявява при Т ° 37 °; Това са двуфазни, биотермални антитела, към които се приписва хемолизалинът - Landshthiner. Всички известни имуноглобулинови класове съдържат пълни антитела. Дейността и спецификата на тях се определят от титъра, авидност (виж aviditet), броя на антиденмана. IGM антителата са по-активни от IgG антитела, при хемолиза и реакциите на аглутинация.
Непълни антитела (Безпечатни, блокиране, аглутиноиди), както и пълни антитела, са способни да се свързват със съответните антигени, но реакцията не е придружена от видима in vitro явлението на утаяване, аглутинация и др.
Непълни антитела са открити при хората през 1944 г. до антигените, те са открити в вирусни, рикциални и бактериални инфекции по отношение на токсините при различни патологични състояния. Има редица доказателства за двубула на непълни антитела. Бактериалните непълни антитела имат защитни свойства: антитоксично, обновяване, бактериологично; В същото време, непълните антитела са открити под редица автоимунни процеси - с кръвни заболявания, особено хемолитична анемия.
Непълни хетеро- и автоантитела са в състояние да причинят клетвни щети, както и да играят роля в появата на лекарство Лео и тромбоцитопения.
Нормално (естествено) се счита за антитела, обикновено срещащи се в серума на животните и лице в отсъствието на изрична инфекция или имунизация. Произходът на антибактериални нормални антитела може да се дължи, по-специално с антигенно стимулиране на нормално тяло на микрофлора. Тези възгледи са теоретично и експериментално обосновани от изследванията на животинските настобионни и новородени в обикновените местообитания. Въпросът за функциите на нормалните антитела е свързан пряко със спецификата на тяхното действие. L. A. Zilber (1958) смята, че индивидуалната резистентност към инфекции и освен това "имуногенната готовност на тялото" се определя от тяхното присъствие. Ролята на нормалните антитела в кръвната бактерицидилност е показана, при фагоцитоза. Произведенията на много изследователи бяха показани, че нормалните антитела са предимно макроглобулин-ми - IgM. Някои изследователи са намерили нормални антитела в IGA- и IgG-класове имуноглобулини. В техния състав, както непълни, така и пълни антитела (нормални антитела към червените кръвни клетки - виж кръвните групи).
Синтез на антитела
Синтезът на антитялото тече в две фази. Първата фаза индуктивна, латентна (1-4 дни), в която не са открити антитела и антитяло клетки; Втората фаза е продуктивна (започва след индуктивната фаза), антителата се намират в плазмените клетки и текат от течни лимфоидни органи. След първата фаза на образуването на антитяло, най-бързата скорост на антитела започва, често съдържанието им може да се удвои на всеки 8 часа и дори по-бързо. Максималната концентрация на различни серумни антитела след еднократна имунизация се регистрира с 5, 7,10 или 15-ти ден; След инжектиране на депозирани антигени - на 21-ви или 45-ия ден. След това, след 1-3 или повече месеца, антителата рязко спадат. Въпреки това, понякога ниското ниво на антитела след имунизацията е регистрирано в кръвта за няколко години. Установено е, че първичната имунизация е голям брой различни антигени, придружени от появата на тежък IgM (19s) -ANTITEL първоначално, след това по време на краткосрочен план - IgM и IgG (7S) и накрая, и накрая, някои белите дробове от 7s антитела. Повторното стимулиране на сенсибилизирания организъм е антиген причинява образуването на образуването на двата класа антитела, съкращаване на латентната фаза на образуването на антитяло, синтеза на 19S антитела и допринася за преференциалния синтез на 7S антитела. Често 19s антитела изобщо не се появяват.
Прогнозираните разлики между индуктивната и продуктивна фаза на образуването на антитяло се намират в изследването на тяхната чувствителност към редица влияния, което е от основно значение за разбирането на естеството на специфичната профилактика. Например, е известно, че облъчването към имунизацията се забавя или напълно потискано от образуването на антитяло. Облъчването в репродуктивната фаза на антитялото не влияе върху съдържанието на антитела в кръвта.
Избор и почистване на антитела
За да се подобри методът за изолиране и почистване на антитела, бяха предложени имуносоргените. Методът се основава на превод на разтворими антигени в неразтворим чрез закрепване чрез ковалентни връзки към неразтворима основа на целулоза, сефадекс или друг полимер. Методът позволява да се получат високо пречистени антитела в големи количества. Процесът на екскреция на антитела, използващ имуносоргени, включва три етапа:
1) екстракция на имунни серумни антитела;
2) пране на имуносорбент от неспецифични протеини;
3) Разцепване на антитела от промития имуносорбент (обикновено буферирани разтвори с ниска рН стойности). В допълнение към този метод са известни и други методи за почистване на антитела. Те могат да бъдат разделени на две групи: специфични и неспецифични. Първото е дисоциацията на антитела от сложния неразтворим антиген - антитяло (утайка, аглутинат). Тя се извършва от различни вещества; Методът на ензимно храносмилане на антиген или флокулат токсин-антитоксин амилаза, трипсин, пепсин е широко разпространен. Термичното елуиране се използва и при Т ° 37-56 °.
Неспецифичните методи за пречистване на антитела се основават на освобождаването на гамабулин: електрофореза в гел, хроматография върху йонообменни смоли, фракциониране на гел филтриране през Sephadex. Методът на валежите е широко известен с натрий или амоняк. Тези методи са приложими в случаи на висока концентрация на серумни антитела, например по време на хиперимунизация.
Глфилтрация през Sephadex, както и използването на йонообменни смоли ви позволяват да разделите антителата по величината на техните молекули.
Прилагане на антитела
Антитела, особено гамабулини, се използват за терапия и профилактика на дифтерия, морбили, тетанус, газов презареждане, сибирски язви, лептоспироза, срещу стафилококови, патогени на бяс, грип и др. Специално приготвен и пречистен диагностичен серум се използват в серологична идентификация на инфекции на инфекции (виж. Идентификация на микробите). Установено е, че пневмококите, стафилококите, салмонела, бактериофаги и т.н., адсорбиращи съответните антитела се придържат към тромбоцитите, еритроцитите и други чужди частици. Този феномен се нарича имунна адхезия. Беше показано, че в механизма на този феномен се възпроизвеждат протеинови рецептори на тромбоцитите и еритроцитите, които се унищожават от трипсин, папаин и формалин. Реакцията на имунната залепване зависи от температурата. Отчита се чрез адхезия на корпускуларния антиген или хемаглутинация, причинена от разтворим антиген в присъствието на антитела и допълнение. Реакцията е силно чувствителна и може да се използва както за определяне на комплемента, така и много малка (0.005-0.01 μg азот) от количеството антитела. Имунната залепване подобрява фагоцитоза левкоцитите.
Съвременни теории за образуване на антитела
Различава се поучителната теория на образуването на антитяло, съгласно антиген, антигенът е пряко или индиректно включен в образуването на специфични имуноглобулини и теории, включващи образуването на генетично запазване на антитела към всички възможни антигени или клетки, които синтезират тези антитела. Те включват теории за развъждане и теорията на репресиите - деребелея, които позволяват възможността за синтезиране с една клетка на всички антитела. Теориите също така предложиха да се разберат процесите на имунологичен отговор на нивото на холистичен организъм, като се вземе предвид взаимодействието на различни клетки и общоприети представителства за синтеза на протеин в организма.
Директна матрична теория Gaurovitz-polinging Той се свежда до факта, че антигенът, който приема вътре в клетките, произвеждащи антитела, играе ролята на матрица, която засяга образуването на имуноглобулинова молекула от пептидни вериги, чиито синтезни потоци без участието на антигена. "Интервенцията" на антигена се появява само във втората фаза на образуването на протеинова молекула - фазата на усукване пептидни вериги. Антигенът така променя терминалните n-аминокиселини на бъдещото антитяло (имуноглобулин или неговите индивидуални пептидни вериги), които те стават допълващи се към детерминантите на антигена и лесно влизат в контакт с него. Антителата, които водят до този начин, се разцепват от антигена, влизат в кръвта и освободеният антиген участва в образуването на нови молекули на антитяло. Тази теория предизвика редица сериозни възражения. Не може да обясни образуването на имунологична толерантност; Най-високото количество антитела, произведени от клетката на единица време върху съществуващите многократно по-малко от антигенните молекули в него; Продължителността на производството на антитела от организма, изчислена в годините или целия живот в сравнение със значително по-малък консервационен период на антигена в клетките и т.н. Трябва също да се вземе предвид, че клетките на плазмата или лимфоида, производството антитела, не успяват антигена, въпреки че присъствието на нативния антиген или неговите фрагменти в клетките, наблюдаващи антитяло, не могат да бъдат напълно изключени. Наскоро Gaurrowitz (F. Haulowitz, 1965) предложи нова концепция, за която антигенът се променя не само на вторичната, но и основната структура на имуноглобулин.
Теория на непряка матрица Бернет - Fenner Получена слава през 1949 година. Неговите автори смятат, че макромолекулата е антиген и най-вероятно нейните детерминанти проникват в ядрото на ембрионални клетки от тип и причиняват причинени от наследници в тях, в резултат на което се причинява образуването на антитела към този антиген. Допуска се аналогия между описания процес и трансдукция в бактериите. Новото качество на образуването на имунни глобулини, придобити от клетки, се предава на потомството на клетките в безброй поколения. Въпросът за ролята на антигена в описания процес обаче беше противоречива.
Това обстоятелство беше причина за теорията за естествения подбор на Ерне (К. Йерн, 1955).
Теорията за естествения подбор на Ерне. Според тази теория антигенът не е матрица за синтеза на антитела и не предизвиква генетични промени в производството на клетки на антитялото. Неговата роля се свежда до избора на съществуващи "нормални" антитела, които спонтанно произтичат от различни антигени. Това се случва така, сякаш би било такова: антигенът, удрящ тялото, намира съответното антитяло, свързва с него; Очакваният антигенен комплекс се абсорбира от клетки, които произвеждат антитела, а последният получава стимул за получаване на антитела от този вид.
Теорията за размножаване на клонела на Бернет (F. Burnet) е по-нататъшно развитие на идеята за ерун при селекция, но не и антитела, но клетки, произвеждащи антитела. Burnet вярва, че в резултат на общия процес на диференциация в ембрионални и постнатални периоди на мезенхималните клетки, много клонове на лимфоидни или имунологично компетентни клетки, способни да реагират с различни антигени или техните детерминанти и да произвеждат антитела - имуноглобулини. Характерът на отговора на лимфоидните клетки върху антигена в ембрионалните и постнаталните периоди е разнообразен. Зародишът изобщо не произвежда глобулини или ги синтезира. Въпреки това се приема, че тези на клетъчни клонове, които могат да се присъединят към реакцията с антигенни детерминанти на собствените си протеини, реагират с тях и в резултат на тази реакция се унищожават. Така че, клетките, образуващи анти-аглутинини при хора с кръвна група А и анти-инглутинин, умират - при индивиди с група кръв. Ако ембрионът въведе всеки антиген, след това по същия начин ще унищожи Съответният клон на клетките и новороденото през следващия живот е теоретично толерантен към този антиген. Процесът на унищожаване на всички клонове на клетките към собствените си протеини на ембриона завършват по време на раждането или излизането от яйцето. Сега новороденото има само "свои" и всеки "чужденец", който падна в тялото му, признава той. Burnet също така позволява запазването на "забранени" клетъчни клонове, способни да реагират с автоантенни на органи, които по време на процеса на развитие се изолират от клетки, произвеждащи антитела. Признаването на "извънземния" се осигурява от останалите клонове на мезенхималните клетки, на повърхността, на която има подходящи антидантрминанти (рецептори, клетъчни антитела), допълват детерминантите на "извънземния" антиген. Естеството на рецептора се определя генетично, което е кодирано в хромозоми и не се въвежда в клетката заедно с антигена. Наличието на готови рецептори неизбежно води до реакцията на този клон на клетки с даден антиген, който сега е два процеса: образуването на специфични антитела - имуноглобулини и репродукцията на клетките на този клон. Burtes приема, че мезенхилната клетка, която е получила антигенно дразнене, по ред на митоза води до популация от дъщерни дружества. Ако такава клетка на селяните в мозъчната субстанция на лимфния възел, тя дава образуването на плазмени клетки, по време на утаяване в лимфните фоликули - лимфоцити, в костния мозък - еозинофили. Дъщерните клетки са склонни към соматични необратими мутации. При изчисляване на цялото тяло броят на мутиращите клетки на ден може да бъде 100 LLC или 10 милиона и следователно мутациите ще осигурят клонингите на клетките към всеки антиген. Теорията на Бернет предизвика голям интерес на изследователите и голям брой експерименти за проверка. Най-важните потвърждения на теорията са доказателство за наличието на клетки, произвеждащи антитяло в предшественик на клетки, произвеждащи антитяло (костни производствени лимфоцити) на антитяло-подобни имуноглобулинови природни рецептори и наличието на взаимосвързания механизъм за изключване на антитела с различна специфичност в антитела.
Теорията за репресиите и draperyscia, формулирани от Silad (L. szilard) през 1960 година. Според тази теория всяка клетка, продуцираща антитяло, може потенциално да синтезира всяко антитяло към всеки антиген, но този процес се инхибира от репресора на ензима, участващ в синтеза на имуноглобулин. От своя страна, образуването на репресора може да се извърши чрез влиянието на антигена. Soruda смята, че образуването на антитела се контролира от специални гени без загуба. Техният брой достига 10 000 за всеки един (хаплоид) набор от хромозоми.
Lederberg. (J. Lederberg) счита, че в гените, отговорни за синтеза на глобулини, има области, контролиращи образуването на центрове за активно антитяло. Обикновено функцията на тези места се забавя и следователно има синтез на нормални глобулини. Под влиянието на антигена и може би под влиянието на някои хормони, той се повдига и стимулира дейността на обектите поколение, отговорни за образуването на активни центрове на антитела, а клетката започва да синтезира имунните глобулини.
Според H. N. Zhukova-Gearge (1972), еволюционните прекурсори на антителата са защитни ензими, подобни на тези, които се появяват в бактерии, с придобит антибиотик-устойчив. Подобно на антитела, ензимите се състоят от активен (по отношение на субстрата) и пасивните части на молекулата. Поради ефективността, механизмът "един ензим е един субстрат", е заменен с механизма на "единични молекули с голяма част", т.е. антитела с променливи активни центрове. Информация за образуването на антитела се осъществява в зоната на "резервните гени", или в "зоната на съкращенията" на ДНК. Такова съкращение, очевидно, може да бъде локализирано в ядрената или плазмидната ДНК, която съхранява "еволюционна информация ..., играе ролята на вътрешния механизъм", е засадена "контролира наследствената вариабилност". Тази хипотеза съдържа поучителен компонент, но не е напълно поучителен.
П. Ф. Здодовски Войни на антигена ролята на ръкохватката на определени гени, контролиращи синтеза на допълнителни антитела. В същото време антигенът, като забранявам предмети в съответствие с теорията на делегациите, досадно аденогипид, което води до соматотропни (STG) и адренокортикотропни (ACTH) хормони. HDS стимулира плазмоцитичната и антитяло-образуващата реакция на лимфоидни органи, на свой ред, стимулирана от антиген, и ACTH, засягащ надбъбречната кора, причинява кортизон. Последното в имунното тяло потиска плазмоцитаната реакция на лимфоидни органи и синтеза на клетките на антитялото. Всички тези разпоредби бяха потвърдени експериментално.
Действието на системата на хипофизни жлези - надбъбречни жлези върху продуктите на антитела могат да бъдат открити само в предварително имунизиран организъм. Именно тази система организира анамнестични серологични реакции в отговор на въвеждането в тялото на различни неспецифични стимули.
Задълбочено проучване на клетъчните промени в процеса на имунологичен отговор и натрупването на голям брой нови факти, обосновани предвидената разпоредба, съгласно която имунологичният отговор се извършва само в резултат на кооперативното взаимодействие на определени клетки. В съответствие с това се предлагат няколко хипотези.
1. Теорията за сътрудничеството на две клетки. Натрупани са много факти, което показва, че имунологичният отговор в организма се извършва при условия на взаимодействие между различните видове клетки. Има потвърждение, че макрофагите първо се асимилират и модифицират от антигена, но по-късно "инструктират" лимфоидни клетки около синтеза на антитела. В същото време се показва, че се наблюдават сътрудничеството и между лимфоцити, принадлежащи към различни субпопулации: между Т-лимфоцитите (зависими от тимус, антинтереактивен, срещащ се от виличната жлеза) и в клетки (зависими от тимус, прекурсори на клетки на антитяло, Лимфоцити на костен мозък).
2. Теория на сътрудничеството на три клетки. Според изгледите на Royrtt (I. Roitt) et al. (1969) антигенът е заловен и обработен от макрофаги. Такъв антиген стимулира антиген-реактивни лимфоцити, подложени на трансформации в бластоидни клетки, осигуряваща свръхчувствителност и трансформиране в дълготрайни имунологични клетки. Тези клетки влизат в сътрудничество с образуващи антитяло прекурсори, които от своя страна се диференцират, пролифериращи се в клетки, произвеждащи антитяло. Според Рихтер (М. Рихтер, 1969), повечето антигени имат слаб афинитет към клетките на антитялото, следователно, за производството на антитела е необходимо следното взаимодействие на процесите: антиген + макрофаг - рециклиран антиген + антиген-реактивен Клетъчно активирано антиген + прекурсорно антитяло-антитела. В случай на висок афинитет на антигена, процесът ще изглежда така: антиген + прекурсор на антитяло клетки - антитела. Предполага се, че при условия на повторно стимулиране с антиген, последният директно влиза в контакт с клетка, образуваща антитяло или имунологична памет. Тази разпоредба се потвърждава от по-голямата радиоустойчивост на повтарящ се имунологичен отговор от първичен, който се обяснява с различната устойчивост на клетки, участващи в имунологичния отговор. Чрез постулиране на необходимостта от триклетъчно сътрудничество в антиреоб-сегенеза, RV Petrov (1969, 1970) счита, че синтезът на антитялото ще се появи само ако стволовата клетка (предшественик на клетката на антитялото) едновременно получава рециклиран антиген от Макрофаг и имуноперник индуктор от антиген-реактивната клетка, образуван след него (антиген-реактивна клетка) антиген стимулация. Ако контактът на стволови клетки се извършва само с обработен антиген на макрофаг, той създава имунологична толерантност (виж имунологичната толерантност). Ако контактът на стволовата клетка се обсипва само с антиген-реактивна клетка, след това се появява синтез на неспецифичен имуноглобулин. Предполага се, че тези механизми се основават на инактивирането на ненужни лимфоцити на стволови клетки, тъй като индуктор на имуноперкова, попадащ в алогенна стволова клетка, е антиметаболик (песни - клетки с идентичен геном, алогенни - клетки от един и същ тип , чрез друг генетичен състав).
Алергични антитела
Алергичните антитела са специфични имуноглобулини, образувани под действието на алергени при хора и животни. Това се отнася до кръвните циркулиращи антитела в алергични реакции на незабавен тип. Трите основни вида алергични антитела се отличават: чувствителност на кожата или реагират; Блокиране и хемаглутинизиране. Биологичните, химичните и физико-химичните свойства на човешките алергични антитела са характерни ( таблица.).
Тези свойства се различават рязко от свойствата на утаяване, комплектуващи се свързващи антитела, аглутинини и други, описани в имунологията.
Реакцията са направени за обозначаване на хомоложни човешки антитела, чувствителни към кожата. Това е най-важният вид човешки алергични антитела, чийто основно свойство е способността да се осъществи реакцията на пасивно прехвърляне на повишена чувствителност към кожата на здрав получател (виж реакцията на Prausnitz-Cutore). Реагите имат редица характерни свойства, които ги отличават от относително добре проучени имунни антитела. Много въпроси, свързани със свойствата на реакторите и тяхната имунологична природа, остават нерешени. По-специално, въпросът за хомогенността или хетерогенността на реакторите е неразрешен в смисъл на тяхната принадлежност към определен клас имуноглобулини.
Блокиращи антитела се срещат при пациенти с залинози в процеса на специфична хипосититизираща терапия към този антиген, който се извършва хипоситизиране. Свойствата на този тип антитела приличат на свойствата на утаяващи антитела.
Под хемаглутиниращи антитела, човешки и животински серумни антитела обикновено се подразбираха, способни на специфично аглутиниращи червени кръвни клетки, свързани с алергена на прашец (реакция на непряка или пасивна, хемаглутинация). Свързването на повърхността на еритроцитите с алерген на полена се постига чрез различни методи, например, с помощта на танин, формалин, два пъти диазотизиран бензидин. Хемаглутиниращи антитела могат да бъдат намерени при хора с повишена чувствителност към поленовите растения, както преди, така и след специфична хипосенизираща терапия. В процеса на тази терапия има преобразуване на отрицателни реакции в положително или увеличаване на титрите на реакцията на хемаглутинацията. Гемаглутинизиращи антитела имат имущество да бъде доста бързо адсорбирано върху еритроцитите, третирани с алерген за прашец, особено някои от неговите фракции. Имуносоргените премахват хемаглутинизиращите антитела по-бързо от реакцията. Хемаглутиниращата активност е свързана до известна степен и със сенсибилизиращите антитела, но ролята на чувствителността на кожата, очевидно, е малка, тъй като няма корелация между чувствителността на кожата и хемаглутиниращите антитела. От друга страна, съществува връзка между хемаглутиниращите и блокиращите антитела при хора с алергии към поленовите растения и в здрав имунизиран зеленчуков прашец. Тези два вида антитела имат много подобни свойства. В процеса на специфична хипосенитизираща терапия има увеличение както в същия тип антитела. Gemagglutizing антитела към пеницилин не са идентични с антитела, чувствителни към кожата. Основната причина за образуването на хемаглутиниращи антитела е пеницилинотерапия. Очевидно, хемаглутинизиращите антитела трябва да се приписват на групата на антитела, наричани автори на "антителата на МИ-свидетели".
През 1962 г., Шели (W. Shelley) предложи специален диагностичен тест въз основа на така наречената дегранулация на заек кръв органични левцити под действието на алергенната реакция със специфични антитела. Въпреки това, естеството на антителата, които участват в тази реакция и свързването им с циркулиращо реагиране не е достатъчно изяснено, въпреки че има данни за корелацията на този тип антитела с нивото на реакторите при пациенти с полиноза.
Създаването на оптимални алергенни съотношения и тестов серум е изключително важен на практически термини, особено в проучвания с алергени, които все още не се съдържат в съответната литература.
Алергичните ангина на животните включват следните видове антитела: 1) антитела с експериментална анафилаксия; 2) антитела в спонтанни алергични заболявания на животните; 3) Антитела играят роля в развитието на реакцията на изкуството (като утаяване). При експериментална анафилаксия, както обикновено, така и местно, в кръвта на животните, откриват специални видове анафилактични антитела, които имат свойството пасивно чувствител на кожата на същия вид.
Доказано е, че анафилактичната сенсибилизация на алергените на морски прасета на ливадата на Тимофевка е придружена от кръвообращението в кръвта на сенсибилизиращите антитела. Тези клетъчни тела имат свойство за извършване на хомоложна пасивна сенсибилизация на кожата in vivo. Заедно с тези хомологични кожени-сенсибилизиращи антитела, с обща сенсибилизация на морски свинчета, алергени, алергени от ол за кръвобед в кръвобедните антитела, открити чрез реакцията на пасивна хемаглутинация с бис-диазотизиран бензидин. Сенсибилизиращи антитела, които извършват хомоложен пасивен трансфер и имат положителна корелация с индикатор за анафиларакция, се наричат \u200b\u200bгрупа от хомоложни анафилактични антитела или хомоцитотропни антитела. Използвайки термина "анафилактични антитела", авторите им приписват водеща роля в реакцията на анафилаксиите. Започнаха да се появяват проучвания, потвърждаващи съществуването на хомоцитотропни антитела към протеинови антигени и конюгати в различни видове експериментални животни. Редица автори идентифицират три вида антитела, участващи в алергични реакции на незабавен тип. Това са антитела, свързани с новия тип имуноглобулин (IgE) при хора и подобни антитела при маймуни, кучета, зайци, плъхове, мишки. Вторият тип антитела - тип антитяло на морското свинче, което може да се фиксира върху мастни клетки и изоложни тъкани. Те се различават до свойствата, по-специално, те са по-термични стабилни. Смята се, че антителата тип IgG могат да бъдат втори тип анафилактични антитела. Третият тип антитела, чувствителни хетероложни тъкани, принадлежащи, например в морски свинчета до клас γ 2. При хора само IgG антитела имат способността да се чувствител на кожата на морското свинче.
В случай на животински заболявания, алергични антитела, образувани с спонтанни алергични реакции. Тези антитела са термолабилни, притежават чувствителни свойства на кожата.
Непълни антитела се прилагат при определяне на антигени на редица изо-осемологични системи (виж кръвните групи), за да се установят кръвоизточници на определено лице в случаи на престъпления (убийства, сексуални престъпления, пътнотранспортни произшествия, телесни наранявания и др. ), както и проверка на противоречивата бащинство и майчинството. За разлика от пълните антитела, те не причиняват аглутинация на червените кръвни клетки в солената среда. Сред тях се отличават антитела от два вида. Първият от тях е аглутиноиди. Тези антитела могат да повдигат червени кръвни клетки в протеин или макромолекулна среда. Вторият тип антитяло - криптаглутиноиди, които реагират в индиректна Cumbac проба с антифремобулин серум.
За работа с непълни антитела се предлагат редица методи, разделени на три основни групи.
1. Методи за конглатиране. Отбелязва се, че непълните антитела могат да причинят аглутинация на еритроцитите в протеин или макромолекулна среда. Като такива среди, кръвта серум AB (не съдържащ антитела), говежди албумин, декстран, биогел - особено пречистен желатин, даден чрез буферен разтвор до неутрално рН и т.н. (виж conglutination).
2. Ензимни методи. Непълните антитела могат да причинят аглутинация на еритроцитите, предварително обработени с някои ензими. За такова лечение, трипсин, фицин, папаин, екстракти от хлебни дрожди, гума, бромелин и др.
3. Проба от Cumbac с антихилобулин серум (виж реакцията на Cumbas).
Непълни антитела, свързани с аглутиноидите, могат да показват действията си във всичките три групи методи. Антителата, свързани с криптогалутиноидите, не могат да аглутинират червените кръвни клетки не само в солен разтвор, но и в макромолекулната среда, както и да ги блокират в последния. Тези антитела се отварят само в индиректната проба от Cumbas, с които не само антитела, свързани с криптоплатиноиди, но и антитела, които са аглутиноиди.
Моноклонални антитела
На допълнителните материали, обем 29
Класическият метод за производство на антитела за диагностични и изследователски цели е да имунизират животните с определени антигени и последващото производство на имунни серуми, съдържащи антитела, необходима специфичност. Този метод има редица недостатъци, свързани предимно с факта, че имунните серуми включват хетерогенни и хетерогенни популации на антитела, които се различават по активност, афинитет (афинитет към антиген) и биологично действие. Конвенционалните имунни серуми съдържат смес от антитела, специфични както по отношение на даден антиген, така и по отношение на замърсяващи протеинови молекули. Новият тип имунологични реагенти е моноклонални антитела, получени чрез хибридни клетъчни клонове - хибридом (виж). Неразтвореното предимство на моноклоналните антитела е тяхната генетично предварително определена стандартна, неограничена възпроизводимост, висока чувствителност и специфичност. Първите хибридоми бяха подчертани в началото на 70-те години на 20-ти век, но реалното развитие на ефективната технология за създаване на моноклонални антитела е свързано с Keler и Milpetein Research (G. Kohler, S. Milstein), резултатите от които са публикувани в 1975-1976. През следващото десетилетие се развива новата посока на клетъчното инженерство, свързано с получаване на моноклонални антитела.
Хибридомите се образуват, когато се образуват хибридоми, когато се образуват лимфоцити от хиперимунизирани животни с клетки с различен произход. Хибридомите наследяват от един от родителите способността да произвеждат специфични имуноглобулини и от втория - имотът е неограничен за умножаване. Клонирани популации на хибридни клетки могат да произвеждат дълго време, за да произвеждат генетично хомогенни имуноглобулини на определената специфичност - моноклонални антитела. Моноклоналните антитела, получени от хибридоми, получени с помощта на уникална мишка клетъчна линия Morse 21 (RZ), са най-широко използвани.
Трудните проблеми на технологията на моноклоналните антитела включват сложността и сложността на получаване на устойчиви високопроизводителни хибридни клонове, които произвеждат моноспецифични имуноглобулини; Сложността на получаване на хибридни производствени моноклонални антитела към слаби антигени, които не могат да индуцират образуването на стимулирани в лимфоцити в достатъчни количества; Отсъствието на моноклонални антитела на определени свойства на имунните серуми, например, свойствата да образуват утайки със комплекси от други антитела и антигени, върху които се основават много диагностични тестови системи; Ниска честота на сливане на лимфоцити, произвеждащи антитела, с миеломични клетки и ограничена стабилност с хибрид в масовите култури; Ниска стабилност в процеса на съхранение и повишена чувствителност на лекарства от моноклонално антитяло към рН промени, инкубационна температура, както и замразяване, размразяване и влияние на химични фактори; Сложността на получаване на хибридни или преведени производители на човешки моноклонални антитела.
Почти всички клетки в популацията на клонираните хибрид произвеждат моноклонални антитела от същия клас и имуноглобулиновия подклас. Моноклоналните антитела могат да бъдат модифицирани с помощта на клетъчни имунни инженерни методи. Така че е възможно да се получат "триомас" и "квадромези", произвеждащи моноклонални антитела с двойна специфичност, промяна на продуктите на пента-размерът цитотоксична IgM върху продуктите на пентагенния непияксиен IgM, мономерна непиярка IgM или IgM с Намален афинитет, както и превключвател (със запазване на антигенна специфичност) IgM секрецията на IgD секреция и IgGl секреция е върху секрецията на IgG2A, IgG2B или IgA.
Геномът на мишката осигурява синтез над 1 х 10 7 различни версии на антитела, специално взаимодействащи с епитопи (антигенни детерминанти) на протеини, въглехидрати или липидни антигени, присъстващи в клетки или микроорганизми. Възможно е да се образуват хиляди различни антитела към един антиген, различен по отношение на спецификата и афинитета; Например, в резултат на имунизация с хомогенни човешки клетки, се предизвикват до 50 000 различни антитела. Хибридната употреба ви позволява да избирате почти всички варианти на моноклонални антитела, които могат да бъдат предизвикани за този антиген в експериментално животно.
Разнообразието от моноклонални антитела, получени в същия протеин (антиген), определя необходимостта от определяне на тяхната по-тънка специфичност. Характеристики и селекция на имуноглобулини с необходимите свойства между множество видове моноклонални антитела, взаимодействащи с тествания антиген, често се превръщат в по-продължителна експериментална работа, отколкото получаването на моноклонални антитела. Тези проучвания включват разделянето на набора от антитела към групи, специфични за един или друг епитопам, последван от селекцията във всяка група от оптимална версия на афинитет, стабилност и други параметри. За да се определи специфичността на епитопа, най-често се използва методът на конкурентен ензимен имуноанализ.
Изчислява се, че първичната последователност на 4 аминокиселини (нормален епитоп) може да се появи до 15 пъти в аминокиселинната последователност на протеиновата молекула. Въпреки това, кръстосаните реакции с моноклонални антитела се наблюдават с много по-малка честота, отколкото може да се очаква, въз основа на тези изчисления. Това се случва, защото не всички от тези зони са изразени на повърхността на протеиновата молекула и се разпознават от антитела. В допълнение, моноклоналните антитела откриват аминокиселинните последователности само в определена конформация. Фактът, че последователността на аминокиселините в протеиновата молекула не е разпределена между протеиновата молекула, и свързващите части на антитялото са много по-големи от минималния епитоп, съдържащ 4 аминокиселини.
Използването на моноклонални антитела е отворило недостъпни възможности за изучаване на механизмите на функционалната активност на имуноглобулините. За първи път, с помощта на моноклонални антитела, е възможно да се идентифицират антигенни разлики в протеините, преди това серологически неразличими. Извършени са нови подтипове и разлики в напрежението между вирусите и бактериите, бяха отворени нови клетъчни антигени. С помощта на моноклонални антитела се наблюдават антигенни връзки между структурите, съществуването на което е невъзможно да се докаже с помощта на поликлонални (обикновени имунни) серуми. Използването на моноклонални антитела е възможно да се идентифицират консервативни антигенни детерминанти на вируси и бактерии с широка специфичност на групата, както и специфични за щам епитопи, характеризиращи се с голяма вариабилност и вариабилност.
Откриването на антигенни детерминанти с моноклонални антитела на антигенни детерминанти, които индуцират производството на защитни и неутрализиращи антитела към причинителите на инфекциозните заболявания, е важно за създаването на медицински и профилактични лекарства. Взаимодействието на моноклоналните антитела с подходящи епитопи може да доведе до функционална активност на протеиновите молекули, както и към алторактични промени, които превръщат конвезирането на активната част на молекулата и блокират биологичната активност на протеин.
Само с помощта на моноклонални антитела е възможно да се изследват механизмите на кооперативния ефект на имуноглобулините, взаимното потенциране или взаимно инхибиране на антитела, насочени към различни епитопамери на същия протеин.
За производството на масови количества моноклонални антитела често се използват асцит тумори на мишки. Конвелизираните лекарства на моноклонални антитела могат да бъдат получени върху не-не-свободна среда при ферментирали суспензионни култури или в диализни системи, в микрокапсулирани култури и видове капилярни култури. За получаване на 1 g моноклонални антитела, се изискват приблизително 0,5 литра асцитна флуид или 30 L културална течност, инкубирани във ферментатори със специфични хибридомни клетки. В производствените условия произвеждат много големи количества моноклонални антитела. Значителни разходи за производството на моноклонални антитела са оправдани чрез висока ефективност на пречистването на протеини върху имобилизираните моноклонални антитела, а коефициентът на пречистване на протеини в едностепенна образуване на афинна хроматография достига няколко хиляди. Афинна хроматография на базата на моноклонални антитела се използва при почистване на хормона на растежа, инсулин, интерферон, интерлевкини, произведени чрез променени от методите на генетични инженерни щамове на бактерии, дрожди или еукариотни клетки.
Използването на моноклонални антитела в диагностичните комплекти се развива бързо. До 1984 г. се препоръчва около 60 диагностични тестови системи, приготвени при използване на моноклонални антитела, се препоръчва за клинични проучвания. Основното място сред тях е заета от тестови системи за ранна диагностика на бременност, определяща съдържанието на хормоните в кръвта, витамини, лекарства, лабораторно заразяване на инфекциозни болести.
Критериите за избор на моноклонални антитела са формулирани за тяхното използване като диагностични реагенти. Те включват висок афинитет към антигена, като осигуряват свързване при ниска концентрация на антиген, както и ефективна конкуренция с приемащите антитела, които вече са свързани с антигени в изследваната проба; Посоката на антигенната част обикновено не се разпознава от антителата на гостоприемника и следователно не са маскирани от тези антитела; ориентация срещу повтарящи се антигенни детерминанти на повърхностните конструкции на диагностицирания антиген; Поливностност, осигуряваща по-висока IgM активност в сравнение с IgG.
Моноклоналните антитела могат да се използват като диагностични препарати за определяне на хормони и лекарства, токсични съединения, маркери на злокачествени тумори, за класифициране и преброяване на левкоцити, по-точни и бързо определяне на връзката с кръвната група, за идентифициране на антигени на вируси, бактерии, най-прости, за Диагностика на автоимунни заболявания, откриване на автоантитела, ревматоидни фактори, определяне на класовете имуноглобулин в серума.
Моноклоналните антитела ни позволяват успешно да разграничим повърхностните структури на лимфоцитите и с голяма точност за идентифициране на основните субел на лимфоцити, класифициране на семейството на левкемия клетки и човешки лимфа. Новите реагенти, базирани на моноклонални антитела, улесняват процедурата за определяне на В-лимфоцити и Т-лимфоцити, Т-лимфоцитни подкласове, превръщайки го в един от простите етапи на преброяване на кръвната формула. С помощта на моноклонални антитела може да бъде избрана една или друга субпопулация на лимфоцити, изключване на съответната функция на клетъчната имунитет.
Обикновено диагностичните препарати, базирани на моноклонални антитела, съдържат имуноглобулини, маркирани с радиоактивен йод, пероксидаза или друг ензим, използван в реакции на имунофонон, както и флуорохроми, например, флуоресцентициациат, използван в имунофлуоресцентен метод. Високата специфичност на моноклоналните антитела е от особена стойност при създаването на подобрени диагностични препарати, повишаване на чувствителността и специфичността на радиоимуно логически, имуноферментар, имунофлуцинтни специфични методи за серологичен анализ, нагласи антигени.
Терапевтичната употреба на моноклонални антитела може да бъде ефективна, ако е необходимо, за неутрализиране на токсините с различен произход, както и антигенативни отрови, за да се постигне имуносупресия в трансплантация на органи, за индуциране на комплементарната цитолиза на туморни клетки, за коригиране на състава на Т-лимфоцитите и имунорегулацията , за неутрализиране на устойчивите антибиотици за бактерии, пасивна имунизация срещу патогенни вируси.
Основната пречка за пътя на терапевтичното използване на моноклоналните антитела е възможността за развитие на неблагоприятни имунологични реакции, свързани с хетероложния произход на моноклоналните имуноглобулини. За да се преодолее това, е необходимо да се получат човешки моноклонални антитела. Успешните проучвания в тази посока позволяват да се използват моноклонални антитела като вектори за целенасочено доставяне на ковалентно свързани лекарства.
Разработват се терапевтични препарати, специфични за строго определени клетки и тъкани и притежават целенасочена цитотоксичност. Това се постига чрез конюгиране на високотехнологични протеини, например, дифтериен токсин, с моноклонални антитела, разпознавайки целевите клетки. Ние, ръководени от моноклонални антитела, химиотерапевтичните средства могат да се изнасят избирателно туморни клетки, носещи специфичен антиген в тялото. Моноклоналните антитела могат да извършват ролята на вектора и когато са вградени в повърхностните структури на липозома, която осигурява доставка на органи или целеви клетки на значителни количества лекарства, затворени в липозоми.
Постоянното използване на моноклоналните антитела не само ще увеличи интелигентоспособността на конвенционалните серологични реакции, но и да подготви появата на фундаментално нови подходи за изследване на взаимодействието на антигените и антителата.
|
Параметри в проучване |
Типове антитела. |
||
|
сенсибилизиране на кожата (реагира) |
блокиране |
gemagglutinizing. |
|
|
Принципа на дефиниране на антитела |
Алерген отговор |
Блокиране на реакцията на алерген-реакцията |
Реакция на индиректна хемаглутинация в епруветка |
|
Съпротивление при t ° 50 ° |
Термолабиле |
Термостабилна |
Термостабилна |
|
Способност да премине през плацентата |
Отсъстващ |
Няма данни |
|
|
Способността да се депозират 30% сулфат амониев |
Не се утаявайте |
Депозит |
Частично се утаяват, частично остават в разтвора |
|
Хроматография върху deea-топлоза |
Разпръснати в няколко фракции |
В първата фракция |
В първата фракция |
|
Абсорбция на имуно-сорбенти |
Бавен |
Няма данни |
|
|
Прецизен с алергени на прашец |
Не, дори след концентрацията на антитела |
След концентрацията на антитела има |
Активността на утаяване не съвпада с хемаглутиндирането |
|
Инактивиране на меркаптан |
Се случва |
Няма да се случи |
Няма данни |
|
Разделяне на папаин |
Бавен |
Няма данни |
|
|
Постоянно утаяване |
Повече от 7 (8-11) s |
||
|
Електрофоретични свойства |
Главно γ1-глобулини |
γ2-глобулини |
Най-асоцииран с γ2 глобулин |
|
Клас на имуноглобулин |
|||
Библиография
Bernet F. Клетъчна имунология, на. от английски, M., 1971; Gaurova C F. Имуноухимия и биосинтеза на антитялото, на. от английски, M., 1969, библиог.; Dossa J. Имунохематология на. от Франц., М., 1959; ЗДОДОВСКИ П. Е. Проблеми на инфекцията, имунитет и алергии, М., 1969, Библиог.; Имунохи-митови, Ед. Л. А. Зилбера, стр. 21, М., 1968; Cabot E. и Meyer M. Експериментална имунохимия, на. от английски, M., 1968, библиог.; Структурата на биосинтезата на антителата. М., 1972, библиог.; Нос L от антитела и имунитет, на. от английски, M., 1973, библиог.; Петров R.V. форми на взаимодействие на генетично различни клетки на лимфоидни тъкани (три клетъчна система от имуногенеза), нагоре. Sovr. Biol., Vol. 69, в. 2, p. 261, 1970; Инхибитори на биосинтезната биосинтеза на Babichev V. A. Антитяло. М., 1974; Ephroimson V. P. Immunogencicics, M., 1971, библиог.
Алергични а. - ADO A. D. Алергия, мултикам. Потупване. Фиология, Ед. H. N. SIROTININ, t. 1, p. 374, М., 1966, Библиог.; ADO A. D. Обща алергология, стр. 127, М., 1970; Polner A. A., Vermont I. E. Izersova T. I. По въпроса за имунологичния характер на реагира наполовина аулиноза, в книгата: probl. Allergol., Ed. A. D. ADO и A. A. Podkolzina, стр. 157, М., 1971; Bloch K. J. Анафилактичните антитела на бозайници, включително човек, програмиране. Allergy, v. 10, p. 84, 1967, библиог.; Ishizaka K. a. ISHIZAKA T. Значението на имуноглобулиновия е във фаничната свръхчувствителност, Ан. Allergy, v. 28, p. 189, 1970, библиог.; Лихтенщайн Л. М., Леви Д. А. А. Ishizaka K. in vitro обърната анапелаксия, характеристики на анти-IgE медиирано освобождаване на хистамин, имунология, V. 19, стр. 831, 1970; Sehon A. H. Heteregenity на антителата в алергични серуми, в книгата: Молек. a. Клетъчна основа на образуването на антитяло, ED. От J. Sterzl, p. 227, Прага, 1965, Библиог.; Stanworth D. R. имунохимични механизми на реакции на свръхчувствителност с незабавни тип, клин. Exp. Имунол., U. 6, p. 1, 1970, библиог.
Моноклонални антитела - Хибридоми: ново ниво на биологичен анализ, изд. R. G. Kennet et al., M., 1983; Rokhlin O. V. Моноклонални антитела в биотехнологиите и медицината, в книгата: Биотехнология, Ед. А. А. Баева, стр. 288, М., 1984; N O W I N S K I R. C. a. о. Моноклонални антитела за диагностициране на инфекциозни заболявания при хора, наука, V. 219, p. 637, 1983; OLLSON L. Моноклонални антитела в клинична имунобиология, деривация, потенциал и ограничения, алергия, v. 38, p. 145, 1983; Мидълта Vies J. G. A. Г. R. monoclonal антитела на хибридома, отвеждане. Заразяват. DIS., V. 5, стр. 9, 1983.
М. В. Земков, Х. В. Журавлева, В. М. Земков; A. A. Polner (всички); А. К. Туманов (съд); А. S. Novokathsky (моноклонални антитела).
Алергичните антитела са голяма група човешки и животински кръв глобулин. Най-важните разлики между антитела от "нормалния" глобулин са тяхната имунологична специфичност и биологична способност да причинят някои алергични реакции.
Много имунни антитела имат свойствата на алергични антитела. Например, антитоксините за бактериални екзотомини са включени в анафилактичния шок, причинен от тези токсини ("токсичен анафилаксис" в I. В. Моргунов, 1963 и т.н.), лизин и коментари, свързващи антитела причиняват алергични реакции "обратния тип", алергичен "цитотоксичен »Шок и различни алергични реакции на цитолиза (Forssman, 1911; Waksman, 1962).
Широколентовата група от алергични реакции се причинява от антитела на вида на усукване и аглутинини; Artus феномен, явление на руда, анафилактичен шок на заек, серумното заболяване, алергии за лекарства (Artlius, 1903; Pirect, 1907; яйчник, 1958). Сред антителата на тази група, такива видове priquses и аглутинини също участват в механизма на алергични реакции, които не са намерени в конвенционални методи, директен макро и микроидрина и т.н., които са открити в кръвта на хората със серум или Животни в кръвта на хора със серум или животни. В анафилактична сенсибилизация след отстраняване на утаините от кръвта, специфичен антиген. Кръвният серум след отстраняване на утаините запазва способността да се прехвърли пасивно състояние на обща или локална анафилаксия. RIFFEFC (1907), а след това Фридбергер (1909) нарича тези антитела анафилактични.
В бъдеще, в проучването на редица форми на алергични заболявания (полинес, "атопични" заболявания, остатъцитологични заболявания), бяха разкрити специални видове алергични антитела. Някои от тях са намерили свойствата на утаините или аглутинините само при специални условия или специална техника на тяхното откриване (съвместна реакция на рецитация, аглутинация на еритроцитите, третирани с предварителна танин и др.). Тези алергични антитела са известни като "ienrecinizing" ("непълни"), алергични студени аглутинини и др.
Тази група алергични антитела заема междинно положение между пълноценни утайки и аглутинини и група алергични антитела, причинявайки сенсибилизация на кожата на здрав човек след приложение, V. Серумът на пациента на пациента наполовина-
zoom ol друг тип алергии на незабавен (химерик) "тип (алергия към гъбички, прах, храна и други алергени). Последният тип Sosa антитела (1925), наречени" реагира "или" атопипи "(фамилното име не е било дадени). Биологични и физични свойства на реакторите се различават значително от свойствата на всички известни имунни антитела.
Напълно особените антитела, включени в механизма на алергични реакции на бавен тип и някои незабавни алергични реакции, са така наречените тъкани, или клетъчни, фиксирани, "претенциозни" антитела. Свойствата и механизмът на действие на тези антитела все още не са достатъчно проучени. По този начин, много видове антитела участват в механизмите на различни алергични реакции, вариращи от антитела с биологични и физикохимични свойства на имунната и завършваща със специални типове антитела, които нямат нищо общо с антитела, които причиняват реакции на имунитет.
Всички алергични антитела могат да бъдат разделени на две големи групи. Първата група включва кръвни антитела и други биологични флуиди (хуморални антитела), към втората група - антитела, седнали по опаковки - тъкани, фиксирани или "отопляеми" (клетъчни антитела). Последната група антитела не трябва да се бърка с хуморални антитела, второ фиксирани PA клетки на гладки мускули, върху други тъкани с пасивни анафилаксия и алергии за първи път (реакция на Schultz - Dale, пасивна кожна анафилаксис - явление на руда, пасивен анафилактичен шок и т.н. .).
Връзката на различните видове алергични антитела може да бъде представена като следната схема (Схема 7).
C H E M A 7
Взаимодействие на различни видове алергични антитела алергични антитела
"Фиксирана фиксирана (клетка)
PR O d iptningning ne cal ality
Блокиране на кожата (защитни антитела)
(реагира)
Биологичните и физико-химични свойства на нормалните и имунните глобулини на човешкия и животинския кръвен серум са в вниманието на съвременните биохимици и имунолози.
Поглед към антителата, включително алергични, като. Върху променените глобули на кръв, разработени в нашата страна, V. A. Barykin (1927), N. F. gamaley (1928) под формата на доктрина за имунитет като функции на колоидното състояние на кръвните протеини (VA Barykip) или под формата на теорията на отпечатъците (NF Gamalei), разработени от Pauling и Hoorgitz и много други имунолози.
Хуморални алергични антитела заедно с имунитет антитела са голямо семейство глобулини, които са получили имота специално за свързване с най-разнообразните алергени,
причинени от образуването или с общо определяне на групите с тях. Според Grabar (1963), антитела и имунните и алергични експрес с физиологична функция за транспортиране на кръвта глобулин в същата степен, както е известно, че трансферните въглехидрат глобулин (гликопротеини), липоиди (липопротеини) и други вещества. Очевидно, в случаите на антитела, тази транспортна функция получава по същото време висока степен на имунологична специфичност, която осигурява антитела със своите защитни или и са били значителни влияния.
Специфичността на някои алергични антитела е относителна. При сенсибилизацията на зайци в един вид полен на растенията, антителата възникват в много видове алергени на цветен прашец (A. D. LEDO et al., 1963). В клиниката на Pollipozov обикновено се наблюдават многовалентна чувствителност към много видове прашеца дървета и билки. Под серумното заболяване се наблюдават ревматизмът антитела, аглутиниращи и лизорни еритроцити на RAM (хетерофилни форлсмени антитела), както и утаява към кръвните протеини на много видове бозайници (заек, котка, куче, плъх, мишка и др.).
Кук и Шърман (1940) в пасивната реакция на трансфер оцветяват възможността за реагиране на алергични антитела с много алергени. С имунизацията на заешкия серум на RAM се образуват и за човешки кръвни протеини, коне и прасета (Landsteiner, Van Sclicer, 1939, 1940).
Алергична реакция Имунният отговор отличава увреждане на собствените си тъкани. Възпаление с хипорегичен характер, подуване, бронхоспазъм, сърбеж на кожата, цитотоксични и цитолитни ефекти, удар - всички тези клинични признаци на алергична реакция са израз на увреждане, причинено от имунния механизъм [Pyzkom v.i. et al., 1984]. Една от характерните характеристики на алергичното заболяване е продуктите на алергични антитела. В проучването на алергични заболявания (полиноза, "атопични" заболявания, имунохематологични заболявания и т.н.) са открити няколко функционално различни алергични антитела. Връзката между различни видове алергични антитела съгласно A. D. ADO (1970) е представена в Схема 1:
Съгласно класификацията на А. D. ADO, алергичните антитела са разделени на две групи: кръвни антитела и други биологични течности (хуморални антитела) и тъканни антитела (фиксирани, "приседна", клетка). Алергични антитела, както и имунни, принадлежат към имуноглобулини. Те имат свойство, за да се свържат специално с алергени, които са причинили тяхното образование или имат общи детерминантни групи [ADO A. D., 1970]. Има пет вида имуноглобулини, различни по физикохимични свойства: IgG, IgA, IgM, IgD, IgE.
Алергични антитела (реагират) По принцип се отнасят до петия тип имуноглобулин - IgE, но сред тях има и двата класа реагира със седиментационен коефициент около 7. Смята се, че LGE се синтезира в лимфоидната тъкан на лигавиците и лимфните възли, поради шока Органи с реактивен тип реакция са респираторни власти, червата, конюнктив. Реагиращият тип реакция е в основата на атопичните заболявания (атопичен дерматит, полиноза, бронхиална астма и др.). Реактивирайте или сенсибилизиращите антитела, открити в серума на пациенти с незабавен тип свръхчувствителност и имат способността да се чувствител на кожата, както и лигавицата на носа, очите, дихателните пътища, които се определят с помощта на алергични тестове .
Появата на блокиращите антитела, дефинирани в RPGA, се дължи на защитния фактор от увреждащия ефект на алергена. Въпреки това, ролята на блокирането на алергични антитела не е напълно проучена. Васните алергични антитела участват в имунокомплекс патологията, свързването на комплемента - в алергични реакции на различни видове (туберкулин, анафилактични, с половин древна, екзема).
Като правило, алергичният отговор е включен не само в, но и ефекторни Т-лимфоцити. Преобладаващото развитие на реакцията в една посока или различна посока до голяма степен се определя от дозата, химичната структура и физикохимичното състояние на антигена. В резултат на влиянието на алергени и междуклетъчни взаимодействия възникват активиране на лимфоцитите, което е придружено от остри биохимични промени. Преди това те се записват в клетъчната мембрана: тяхната пропускливост се увеличава за много вещества, активността на цикли, която регулира нивото на цикличния нуклеотиден цикличен аденозин монофосфат (CAMF) и цикличен генозинов монофосфат (CGMF). Преобладаването на първото определя разпространението на процеса на зреещи клетки, преобладаването на втория води до повишаване на клетъчното делене. Многобройни биохимични промени се записват и в цитоплазма, гранули и клетъчна сърцевина. Процесът на активиране на лимфоцитен синтез в ДНК клетки е завършен, синтеза на РНК и протеин се засилва.
Ефективни Т-лимфоцити (T-Killers) Secrete Mediators, които определят биологичния им ефект (например, лимфотоксини). Значителни промени се отнасят до техните мембрани: съдържанието на повърхността им на някои макромолекули се променя, някои маркери изчезват, а други се появяват. T-Killers не губят рецептори за антигена: те са необходими за разпознаване на целевите клетки, към които те засягат.
Сред клетъчните механизми на цитолизата, цитотоксичност, дължаща се на имунните т-убийци. Т-клетъчната цитолиза е съставена от няколко етапа: създаването на контакт между убиеца и целевата клетка (тази фаза е обратима - разделянето на клетките предотвратява смъртта на целевите клетки), програмиран лизис (целевата клетка изглежда жизнеспособна, но е жизнеспособна, но е жизнеспособна обречени до смърт) и завършването на лизис. Целевите клетки, убити от един от посочените механизми, се елиминират от макрофаги и други фагоцидични клетки.
- Механизмът за развитие на алергични заболявания зависи от участието на различни алергични антитела и Т-лимфоцити-ефектори. A. D. ADO Всички алергични реакции разделят на True, или всъщност алергични и фалшиви или псевдо-алергични (не-имунологични). Истински, или алергич, авторът разделя химерик (в зависимост от тях) и циргичен (t зависим). Най-голямото разпределение в алергологията е класификацията на Gella - Cumbas, в съответствие с които трябва да се разграничат алергичните реакции:
- Тип I - анафилактика, в която участват IgE- и по-рядко IgG4 антитела;
- Тип II - цитотоксична с участието на IgG и IgM антитела по време на адсорбция на алерген върху целевите клетки;
- III тип (вид на ARTUS) - увреждане на имунния комплекс с участието на IgG и IgM антитела;
- Тип IV - забавяне на свръхчувствителност, прилаган от Т-лимфоцити.
Механизмен механизъм за алергичен реакцията Състои се в следното: когато алергенният хит, сенсибилизираните лимфоцити се образуват в тялото. Това са Т-популации на лимфоцити, които имат структурни структури, вградени в мембраната, играят ролята на антитела и способни да се свързват с антигена. Многократно проникват в тялото, алергенът е свързан към сенсибилизирания лимфоцит, който води до активиране и пролиферация на клетки, повишавайки синтеза на ДНК и РНК, секрецията на лимфокинови медиатори. Някои лимфокини допринасят за мобилизирането на различни клетки, други (с хемотактична активност) - активират хемотаксия на макрофаги, полиморфни ядрени клетки до местоположението на алергена. Под влиянието на други медиатори те се забавят на това място, тяхната фагоцитна активност се увеличава. В допълнение, лимфокините имат цитотоксична, инхибиторна активност на клетките. Директният цитотоксичен ефект върху целевите клетки може да има лимфоцити-убийци. На мястото, където се появява Almphocyte съединение с алерген, адсорбирани клетки, разрушаването на тези клетки, последвано от фагоцитоза на клетъчния татко и пропускливостта на съдовете се увеличава, т.е. картината на възпалителния отговор на производствения тип се развива.
Имунологичен етап на свръхчувствителност Бавен тип се характеризира с активирането на тимусната система, зависима от имунитета. Сенсибилизираните лимфоцити в алергичната реакционна реакция са 1-2%. Останалите клетки измежду безсмислилизираните привлечени поради действието на лимфонините. Патрохимният етап IV на алергичната реакционна реакция се характеризира с освобождаване на медиатори - лимфоцини в резултат на взаимодействието на Т- и В лимфоцити с алергени. Най-проучваните следните лимфокини:
- 1. Фактор в депресиращата миграция на макрофаги (мит), която допринася за натрупването на макрофаги в областта на алергичното твърдение, повишава тяхната активност и фагоцитоза.
- 2. Фактор, който стимулира образуването на ендогенния пироген.
- 3. Митогенни фактори: лимфоцитен митогенен фактор (LMF), интерлевкин 1 на произход на макрофаги и интерлевкин 2, подчертан от T-Hellers.
- 4. Котерактивен фактор, водещ до хемотаксис на подходящи левкоцити (макрофаги, неутро-филтър, базофилни и еозинофилни гранулоцити).
- 5. лимфотоксини, които причиняват повреда или унищожаване на различни целеви клетки.
- 6. коефициентът на кожата, върху който зависи тежестта на възпалението. Намаляването на избора на кожен реактивен фактор на лимфоцитите на кръвта говори за потискането на клетъчния имунитет.
- 7. Прехвърляне на фактор, предаващ "имунологична памет" върху чувствителния алерген.
В увреждащото действие, с изключение на медиатори на лимфоцити и макрофаги, участват лизозомални ензими, кинини и други системи.
Патофизиологичен етап на алергична реакция Бавното действие се характеризира с увреждащ ефект на сенсибилизирани лимфоцити върху целевата клетка. Цитотоксичният ефект на Т-лимфоцитите е възможно чрез лимфотоксин, косвено, както и поради освобождаването на лизозомни ензими в процеса на фагоцитоза.
Медиаторите на патохимичния етап на алергичната реакция IV тип форма възпаление, която, от една страна, защитен фактор, от друга страна, фактор за увреждане, нарушаване на функцията на този орган, където се развива.
При алергични реакции на непосредствен тип е необходимо да се запазят хуморалните антитела, които са протеини от типа и са свързани само със специфични антигени. Антиген комплекс - антитялото причинява различни щети в тялото. Разтворимите антигени най-често причиняват реакцията на утаяване; Антигени под формата на еритроцити, бактерии, вируси, колоидни частици със съединение със специфични антитела - реакцията на аглутинация. За откриване на антитела в имунологията, използването на различни реакции.
Антителата се произвеждат от лимфоидни клетки на лимфни възли, далак, костния мозък, бадеми. Те могат да бъдат намерени в кръвта за 7-15 дни след прилагането на алергена. Максималното ниво на антитела се наблюдава в кръвта в продължение на няколко седмици и повече, след това продуктите на антителата намаляват и могат да бъдат открити в кръвта в минимални количества в продължение на няколко месеца. Продължителността на живота на антителата, циркулираща в кръвта, е 20 дни; Това показва дълъг синтез от техните имунокомпетентни клетки.
Антителата принадлежат към кръвните серумни глобулини. Повечето новородени бозайници глобулини са много малки - те имат липсата на антитела. В рамките на няколко седмици след раждането има увеличение на кръвния глобулин и паралелно увеличаване на нивото на антитела.
Новороденото бебе има нива на гама-глобулин към нормалното, обаче, повечето от тези гама-глобулини са майчински. Съдържанието на гамабулини се намалява през първите два месеца на живота, защото собствените му продукти на глобулините са изключително слаби. Само през третия месец от живота, продуктите на гамабулин достигат определено ниво.
С помощта на метода на електрофореза, различни протеинови серумни фракции могат да бъдат разделени и да се определи кои фракции на глобулините включват антитела.
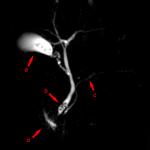
Така е установено, че антителата принадлежат към различни глобулинови фракции - от гама до алфа (това са имуноглобулини) (фиг. 5).
Фиг. 5. Имуноелектрофореза на нормален кръвен серум.
Антитела, които се образуват в организма с различни инфекции, ваксинации, в повечето случаи се отнасят до гама глобулин с молекулно тегло до 180,000. В първата фаза на продуктите на антитялото са открити макробулинс с молекулно тегло до 900,000. Основното свойство на Антителата са способността им да се свързват с антигени. Или по-точно с определени групи от техните молекули, които причиняват образуването на антитела. Химичната структура на тези групи с антигенна специфичност все още е неизвестна. Предполага се, че специфичността на антителата се определя от редица полипептиди или три до четири захарни молекули.
"Парцелът" на молекулите на антитялото, който играе роля в реакцията на антиген-антитялото, е много малък. Модерните имунологични изследвания (дифузия, електрофореза, ултрацентрофугиране) позволяват да се установи, че повечето от имунните антитела имат два специфични "парцела" на всяка молекула, с която антитялото е свързано към специфичен антиген, е антитялото валент. Степента на атракция на антигена и антителата се дължи на електростатичните и междумолекулни сили, които са притежавани от макромолекули, както и от други: силите на силите на Кулон, ван дер Ваалс, както и водородни връзки и ковалентност. Всичко това определя характерната структура на протеиновата молекула.
Антигенната реакция - антитялото протича много бързо. Изчислено е, че пълното протеиново съединение и антипротеин се появяват в рамките на няколко секунди при 0 °.
Образуването на комплекса антиген антитела се дължи на двойната валентност на антитела и антиген поливализма. Според Marack, реакцията между двувалентни и поливалентни молекули води до образуването на съединението, чиито размери непрекъснато се увеличават, тъй като са свързани нови молекули - се образуват конгломерати, броят на хидрофилните групи от които намаляват, така формулирани неразтворими утайки.
Реакцията на превантиране е много специфична и с много методи е възможно не само да се открият трансципитиращите антитела в серума, но и да се определи тяхното ниво.
Механизмът на аглутинационната реакция има много общо с механизма на реакцията на утаяване. Антиген в тези реакции са бактерии, равномерни кръвни елементи, както и инертни частици, покрити с разтворим антиген отгоре. При тази реакция антителата са свързани към антигени върху повърхността на клетките и частиците.

Фиг. 6. Схемата на комплекса е антиген - антитяло. А - зона на излишък от антиген; Б - точка на еквивалентност; Б - излишните антитела.
Благодарение на двувалентната антитела, всяка молекула на антитяло е свързана с две частици от антигена, образувайки мост между тях (фиг. 6), докато клетките или частиците са аглутинирани. Реакцията на аглутинацията е строго специфична.
Има много методи за реакция на аглутинация, с което е възможно да се определи нивото на аглутиниращи антитела в серума. Тези реакции имат висока чувствителност и достатъчна точност. При серологични реакции най-голямото размножаване на имунния серум, който дава аглутинация с микробни тела или кръвни клетки, претеглени в физиологичния разтвор. В имунологията те поставят индиректна реакция, докато използват нормални агнета или човешки еритроцити, които са фиксирани от антигена. Еритроцитите могат да бъдат подредени по инертни частици: латекс, колодий, полистър и др. Определете най-голямото разреждане на серума, което дава видима аглутинация. Различни модификации на аглутинационната реакция могат да определят антитела на много ниски нива - до 0.005 ug азот от протеин на антитяло в 1 ml.
При развитието на алергични реакции както на незабавен и бавен тип, могат да бъдат разграничени следните етапи (A. D. ADO):
- 1) етап на имунни реакции;
- 2) етап на патохимични разстройства;
- 3) Етап на патофизиологични разстройства.
Етап на имунни реакции
Етапът на имунните реакции се характеризира с натрупване в тялото на антитела, специфични за този алерген. Първоначалните етапи на развитието на алергичната реактивност се напомнят до голяма степен от процеса на имунната разработка (следователно и името "етап на имунните реакции"), а именно, алергенът е фиксиран в клетките на ретикулоснолищната система и причинява плазма на лимфоидни клетки . В последния започва образуването на антитела. Алергичните антитела, както и имунните, имат висока степен на специфичност, т.е., са свързани само с алергена, който е причинил тяхното образование. Алергичните антитела се намират в глобулинови фракции на серумните протеини. Мястото и механизмът на образуването на алергични антитела не се различават фундаментално от тези за имунни антитела. Външният вид в тялото на специфични алергични антитела и определя състоянието на сенсибилизация, т.е. появата на повишена чувствителност към някои алергени y (от лат. Sensibilis е чувствителен). Разграничаване на сенсибилизацията активни и пасивни .
Активна сенсибилизация Това се случва, когато алергенът се въведе в организма на животното с парентерален начин (интрамускулно, подкожно, в подложките на лапите, в коремната кухина, в цереброспиналната течност, инхалацията и т.н.). За сенсибилизация много малко количество алерген е определено количество стотни и хиляди грама (фиг. 14). Състоянието на повишена чувствителност не се случва веднага след инжектирането на алерген и след 10-14 дни тя остава при животни в продължение на 2 месеца и повече и след това постепенно изчезва. Човешката сенсибилизация може да продължи много месеци и години.
В процеса на сенсибилизация фагоцитната активност на клетките на ретикулоснотелиална система се засилва, започва плазмата на лимфоидните клетки и започва антителата в тях.
От първите дни на сенсибилизацията в багажниците на соматични и вегетативни нерви, увеличаване на възбудимостта, функционална мобилност върху N. E. vvedensky, съкращаване на хроначия се наблюдава. Рецепторите на вътрешните органи и кръвоносните съдове преминават през фазови промени, възбудимостта им първоначално се увеличава и в бъдещото потискане.
Пасивна чувствителност Това се случва, когато серумът е въведен със здраво животно от друго активно чувствително животно (за 5-10 ml морско свинче за заек 15-20 ml). Състоянието на повишена чувствителност се осъществява след 18-24 часа след прилагането на серума. Този път е необходимо, така че антителата, съдържащи се в извънземния серум, са успели да бъдат фиксирани в телесните тъкани.
Възможно е да се чувстват пасител на органите (черва, матка, бели дробове и др.), Поставяйки ги в сряда с антитела; Въвеждането на готови антитела в кожата причинява местна пасивна сенсибилизация.
Свойства на алергични антитела
Алергичните антитела са модифицирани кръвни глобулини. Най-важните биологични свойства на тях са:
- но) имунологична специфичност, т.е. способността да се свързва именно с алергена, който причинява производството на тези антитела;
- б) способност след съединение с алерген причиняват някои алергични реакции.
Всички алергични антитела могат да бъдат разделени на две групи:
- 1) фиксирани (или клетки) антитела, тясно свързана с клетките и участващи в алергични реакции на бавен тип;
- 2) безплатни (или циркулиращи) антителаОснована в кръвта и други биологични течности на тялото и причиняват незабавно алергични реакции.
Циркулиращи антитела разделена на ускоряваща и не-награда . Последното включва така нареченото блокиране на антитела и някои други.
Утаяване на антитела (IgG) се намират в кръвта при човешко серумно заболяване, анафилактичен шок от човешки и животно, алергично възпаление при зайци (явлението на Artus), алергични реакции към яйчен протеин, пърхот с конски сили и някои други алергични реакции. Преципин термостабилен.
Реактивирайте или кожата - сенсибилизиращи антитела IgE се появява в серума на пациенти с олиноза или атунова бронхиална астма. Реакторите не се откриват при използване на конвенционални серологични реакции в епруветката (утаяване, свързване на връзката и т.н.), но те могат пасивно да се чувстват на кожата на здравия човек и са наречени с антитела, чувствителни към кожата. Най-надеждният метод за откриване на реактори е реакцията на Praushnitz-Cutore (реакцията на пасивна чувствителност на кожата). Серумът на алергичен пациент в количество от 0.05-0.1 ml се въвежда по едно и също време здрав човек. След един ден, специално подбрана доза алерген се въвежда на същото място. В случай на положителна реакция, се появява хиперемия, подуване, сърбеж (фиг. 14).
Термолабилът реагира, тяхната активност е значително намалена след нагряване на серума до 56 ° за 2-4 часа. Най-важното биологично свойство на реакторите е тяхната "биспецификасност", т.е. способността за свързване, от една страна, с клетка на чувствително животно, от друга, с антиген. Това се дължи на фиксирането върху клетките и се проявява вредната способност на реакторите.
Фиксирани или клетъчни, антитела Участвайте в механизма на бавни алергии. Въз основа на факта, че бавните алергии могат да бъдат предадени на друго животно или лице, само с помощта на клетки (лимфоцити) на сенсибилизирания организъм, се прави заключението, че антитялото, причинено от алергия към бавно тип, трябва да се съдържа в клетките. Понякога се нарича "фактор за прехвърляне" на сенсибилизацията. Този фактор е освободен от сенсибилизираната клетка (лимфоцити и други клетки) и чрез течна тъканната среда попада в други клетки. Като ги засягат, това причинява състоянието на сенсибилизация в тях, отново освободени от тях и да се чувстват следните клетки. По този начин малко количество алерген може да сенсибилизира голям брой клетки. Естеството на трансферния фактор определено не е известно. Само някои от неговите свойства са известни; При хората, тя е устойчива на действието на РНК-ASE, ДНК-ASE, трипсин, е в състояние да се движи през диализна мембрана, има молекулно тегло от около 10,000.
Етап на патохимични изменения
Ако са в сенсибилизирани (т.е. съдържащи алергични антитела), тялото се въвежда повторно чрез специфичен алерген, след това се образува физико-химична реакция между антителата и алергените и се образува макромолекулен комплекс на алергенното антитяло. Фиксирането в тъканите, този комплекс причинява редица промени в метаболизма. На първо място, количеството на кислород, погълната от тъканите, се променя, това е фазов знак (първо увеличение, след това намаление).
Под влиянието на комплекса на алерген-антитялото се появяват тъканни и клетъчни протеолитични и липолитни ензими, което води до нарушение на функциите на съответните клетки. Например, следствие от увреждане на мастните клетки на съединителната тъкан, кръвните левкоцити (особено базофилите и неутрофилите) е освобождаването на хистамин, серотонин и някои други биологично активни вещества.
Хистамин. В човешкото тяло и животно, хистаминът се съдържа в мастните клетки на съединителната тъкан, кръвните базофили, в по-малка степен - в неутрофилни левкоцити, тромбоцити, в гладки и напречни мускули, чернодробни клетки, епител на стомашно-чревния тракт и др.
Участието на хистамин в механизма на алергиите се изразява във факта, че причинява спазъм на гладките мускули (например бронхиол, матката, червата и т.н.) и увеличава пропускливостта на кръвните капиляри, поради подуване, уртикария, Петечия Освен това, хистаминът увеличава хидрофилността на влакната насипна съединителна тъкан, допринасяща за свързването на вода в тъканите и появата на обширен оток на вида на вида на набъбване (Фиг. 15).

Хистаминът участва в механизмите на такива алергични реакции при хора, като сърбеж, уртикария, краткосрочни хипотеп. Хипотензивните реакции на вида на колапса (или шок) са най-вероятно участието на кинини (Bradykin) и постоянен бронхоспазъм (с бронхиална астма) - действието на бронхиалното дърво на така нареченото бавно реагиране вещество.
Бавно реагира на алергично вещество (MRS-A). Това е вещество, химическа структура близо до неврамининова киселина или глюкозиди на тези киселини. Това вещество води до бавно намаляване на гладките мускулни тела, за разлика от бързото намаляване, причинено от хистамин. MRCs-a Причините Spast Bronchiole Man, неговата активност не е потисната от антихистаминови вещества и протеолитични ензими. Махането на жалби с алергични реакции са мастни клетки на съединителната тъкан. Предполага се, че това вещество е от голямо значение в появата на бронхоспазъм в бронхиалната астма при хората.
Серотонин (5-окситриптамин) - съдържат почти всички тъкани на тялото, но особено много от нея в мастните клетки на съединителната тъкан, далаклетки клетки, тромбоцити, агенофилни и ентерохромафин клетки на стомаха, панкреаса, в някои нервни клетки, особено в хипоталамуса.
Информацията за участието на серотонина в алергични реакции е доста противоречива. В експериментите на животни беше установено, че морските свинчета, котки, плъхове причиняват бронхоспазъм. При плъхове и мишки серотонинът е освободен от мастните клетки под влиянието на яйчен протеин, декстран и някои други вещества. Има рязко подуване на лицето, яйцата, лапите (анафилактоидна реакция).
В алергичните реакции на човек серотонинът няма значителна стойност.
Bradykin. - полипептид, състоящ се от 9, оставяйки аминокиселини (аргинил-навес-glycl-фенилаланил-серилен навес-фенилаланил-аргинин). Образува се от алфа-2-глобулин кръв под влиянието на протеолитични ензими. В анафилактичен удар, протеолитичните ензими се активират в резултат на ефектите на комплекса на алергенния антитяло върху клетъчни протеази, като калидин, калипелин.
Bradykinis участва в патогенезата на анафилактичен шок при хора и животни: разширява кръвните капиляри, увеличава тяхната пропускливост, намалява тонуса на артериола и причинява хипотония.
Хепарин - кисело мукополизахарид, съдържа много в гранулите на мастните клетки. Освобождаването на хепарин от мастните клетки и потока му в кръвта се наблюдава при кучета с анафилактичен и пептонов удар, както и в инжекции в кръвта на веществата, причиняващи освобождаването на хистамин. В същото време кръвта коагулацията се забавя при кучета. Други животни (зайци, морски свинчета, плъхове) коагулацията на кръвта не се променя. Участието на хепарин в човешки алергични реакции е проучено малко.
Ацетилхолин - В свободните и свързани тъканни протеини се съдържа в почти всички органи. Участва в механизма на алергични реакции главно от онези органи и тъкани, където холинергичните реакции са пряко включени в нормални физиологични процеси (например синаптичните връзки на автономната и централната нервна система, инервармата на сърцето, червата и др. ). В процеса на сенсибилизация активността на халинестеразата на тъканите и промените в кръвта се променя и с допустимо прилагане на алергени е подобрено освобождаване от ацетилхолинови тъкани.
Етап на патофизиологични промени
Патофизиологичният етап на алергичните реакции е ограничена експресия на тези имунни и патохимични процеси, настъпили след въвеждането на специфичен алерген в сенсибилизирания организъм. Тя се развива от реакцията от повредените клетки на клетките, тъканите, органите и тялото като цяло.
Алергични повреди на отделни клетки Добре проучен върху примера на червени кръвни клетки, тромбоцити, кръвни левкоцити, клетки на съединителна тъкан - хистиоцити, мастни клетки и др. Повреда се нанася върху нервни и гладки мускулни клетки, сърдечен мускул и др.
Отговорът на всяка от повредените клетки се определя от нейните физиологични характеристики. Така че в нервната клетка има електрически потенциал за повреда, в миофибрилите на гладките мускули - контрактура; Еритроцитите се подлагат на хемолиза. Увреждането на левкоцитите се изразява в преразпределение в протоплазмата на гликоген, в лизис. Зърнените клетки набъбват и изхвърлят техните гранули - настъпва клетъчна дегранулация. Последният процес е особено рязко изразен в базофилите на кръвта и мастните клетки на свободната съединителна тъкан, чиито гранули са особено богати на различни биологично активни вещества, които са алергични реакционни медиатори (фиг. 16).

Алергична тъкан и увреждане на органите Това се случва в резултат на увреждане на клетките, които съставляват тази тъкан, от една страна, и в резултат на нарушеното нервно и хуморално регулиране на функциите на тези органи, от друга. Така че, контразата на гладките мускули на малкия бронхи дава бронхоспазъм и намалява лумена въздухоплавателни пътища. Въпреки това, в сложния механизъм на акта на дишането с бронхиална астма (появата на издишване на дишане), има и промяна в възбудимостта на дихателния център и чувствителните нервни окончания на скитния нерв, в стените на алвеола ( нарушение на рефлекса на Geering Breiler) и интензивна секреция на слуз, блокиране на бронхиола и разширителни капиляри, които увеличават алвеолите и увеличават пропускливостта на стените на капилярите.
Разширяването на кръвоносните съдове и увеличаване на пропускливостта на капилярите, което води до нагряване на течната част на кръвта в тъканта и получената поява на градския подуване, зависи от действието на съдовете на алергичните медиатори (хистамин) \\ t , серотонин), така че от разстройството на периферното и централното регулиране на съдовия тон. Общият израз на патофизиологичната фаза на алергичните реакции е реакцията на организма като цяло, някои алергични заболявания или алергични синдроми.