Protilátky - proteíny globulínovej frakcie ľudského krvného séra a teplokrvných zvierat, čo vedie k odozve na zavedenie do tela rôznych antigénov (baktérie, vírusy, proteínové toxíny atď.) A špecificky interakciu s antigénmi, ktoré spôsobili svoje vzdelanie. Väzbou na aktívne miesta (centrá) s baktériami alebo vírusmi, protilátky bránia ich reprodukcii alebo neutralizovať toxické látky uvoľnené. Prítomnosť protilátok v krvi naznačuje, že telo sa berie do úvahy s antigénom proti ochoreniu spôsobenej ním. Do akej miery závisí imunita na protilátkach a do akej miery protilátky len sprevádzajú imunitu, je riešená vo vzťahu k špecifickej chorobe. Stanovenie hladiny protilátok v krvnom sére vám umožní posúdiť intenzitu imunity aj v prípadoch, keď protilátky nehrajú rozhodujúcu ochrannú úlohu.
Ochranný účinok protilátok obsiahnutých v imunitnom sére je široko používaný v terapii a prevencii infekčných ochorení (pozri seroprofylaxiu, seroprofylaxiu). Reakcie protilátok antigén (sérologické reakcie) sa používajú pri diagnostike rôznych ochorení (pozri sérologické štúdie).
História
Dlho o Chem. Príroda A. Poznal veľmi málo. Je známe, že protilátky po zavedení antigénu sa nachádzajú v sére, lymfy, tkanine extraktoch a že špecificky reagujú s ich antigénom. Prítomnosť protilátok bola vyskúšaná na základe tých viditeľných agregátov, ktoré sú vytvorené pri interakcii s antigénom (aglutináciou, zrážaním) alebo zmenou vlastností antigénu (neutralizácia toxínu, lýzy buniek), ale s ktorými protilátky chemického substrátu sú spojené, takmer nič nebolo známe.
Vďaka použitiu metód ultracentrifugácie, imuno-elektroforézy a mobility proteínov v izoelektrickom poli sa protilátky ukázali ako v triede gama globulínov alebo imunoglobulínov.
Protilátky sú normálne globulíny, ktoré sú predformované v syntéze. Imunitné globulíny, získané v dôsledku imunizácie rôznych zvierat rovnakým antigénom a imunizáciou rovnakého typu zvieraťa s rôznymi antigénmi, majú nerovnaké vlastnosti, ako aj sérové \u200b\u200bglobulíny rôznych typov zvierat.
Triedy imunoglobulínu
Imunoglobulíny sa vyrábajú imunokompetentnými bunkami lymfoidných orgánov, sa líšia od seba. Hmotnosť, sedimentácia konštanta, elektroforetická mobilita, obsah sacharidov a imunologická aktivita. Existuje päť tried (alebo typov) Immunoglobulíny:
Imunoglobulíny M (IGM): Molekulová hmotnosť približne 1 milión, mať komplexnú molekulu; Prvá sa objaví po imunizácii alebo antigénnej stimulácii, majú deštruktívny účinok na mikróby, ktoré klesli do krvi, prispievajú k ich fagocytózii; slabšie ako imunoglobulíny G sú viazané rozpustné antigény, toxíny baktérií; Telo je zničené v tele 6-krát rýchlejšie ako imunoglobulíny G (napríklad u potkanov polčasom imunoglobulínu M je 18 hodín a imunoglobulín G - 6 dní).
Immunoglobulíny G (IgG): Molekulová hmotnosť je asi 160 000, považujú sa za štandardné alebo klasické protilátky: ľahko prejsť cez placentu; sú vytvorené pomalšie ako IGM; Najefektívnejšie viažu rozpustné antigény, najmä exotoxíny, ako aj vírusy.
Imunoglobulíny A (IGA). Kolostrum, sliny, slzy, intestinálny hlien, potok oddelený nosom, v krvi, sú v krvi menej, ľahko spojené s bunkami tela; IGA sa zdalo, zrejme v procese evolúcie chrániť sliznice z agresie baktérií a prenos pasívnej imunity na potomstvo.
Immunoglobulíny E (IGE): Molekulová hmotnosť približne 190 000 (podľa R. S. Nezlin, 1972); Zdá sa, že sú alergické protilátky - tzv reagovať (pozri nižšie).
Immunoglobulíny D (IGD): Molekulová hmotnosť približne 180 000 (podľa R. S. Nezlin, 1972); V súčasnosti je o nich veľmi málo.
Štruktúra protilátok
Molekula imunoglobulínu pozostáva z dvoch neigdentických polypeptidových podjednotiek - pľúc (L - z anglických svetlo) reťazcov s molekulovou hmotnosťou 20 000 a dvoma ťažkými (H - z anglických ťažkých) reťazcov s molekulovou hmotnosťou 60 000. Tieto reťazce spojené s disulfidovými mostu tvoria Hlavný monomér LH. Vo voľnom stave sa však takéto monoméry nenachádzajú. Väčšina molekúl imunoglobulínu sa skladá z dimérov (LH) 2, zvyšných - z polymérov (LH) 2N. Hlavné N-koncové aminokyseliny ľudskej gama globulínu sú aspartánske a glutamy, králičie-alanín a kyselina asparaginová. Porter (RR Porter, 1959), ovplyvňujúci imunoglobulíny papainom, zistili, že sa rozpadajú do dvoch (I a II) Fab fragmentu a Fc fragment (III) s kondenzáciou sedimentácie 3,5s a molekulovou hmotnosťou približne 50 000. Väčšina sacharidov spojených s fragmentom Fc. Pri návrhu odborníkov, ktorí majú nasledujúcu nomenklatúru fragmentov protilátok: Fab fragment je monovalentný, aktívne sa spojí s antigénom; FC fragment - neintekuje s antigénom a pozostáva z polovice C-terminálnych častí ťažkých reťazcov; FD-FRAG-COP - graf ťažkého reťazca, ktorý je súčasťou fragmentu Fab. 5s pepsínsky hydrolýza fragment sa navrhuje, aby označil ako F (AB) 2 a monovalentný 3,5s fragment - Fab.
Špecifickosť protilátky
Jedným z najdôležitejších vlastností protilátok je ich špecificita, ktorá je exprimovaná v skutočnosti, že protilátky sú aktívnejšie a úplne interaguje s antigénom, ku ktorému sa telo stimulovalo. Komplex antigénu je protilátka v tomto prípade má najväčšiu silu. Protilátky sú schopné rozlíšiť menšie zmeny v štruktúre antigénu. Pri použití konjugovaného antigénu, pozostávajúceho z proteínu a jednoduchý chemický - GAPTAIN, tvorený protilátkami sú špecifické pre Hapten, proteín a proteínový komplex - Hapten. Špecifickosť je spôsobená chemickou štruktúrou a priestorovým vzorom antidenténnych protilátok (aktívne centrá, prúdové skupiny), to znamená, že oblasti protilátok, ktoré spájajú s determinantmi antigénu. Počet Antitermineixu protilátok sa často nazýva ich valencia. Molekula IgM protilátky teda môže mať až 10 valencií, molekuly protilátok IgG a IgA sú dvojmocné.
Podľa Karšasha (F. Karush, 1962), aktívne IGG centrá pozostávajú z 10-20 aminokyselinových zvyškov, čo je približne 1% všetkých aminokyselín molekuly protilátky, a podľa reprezentácií Winkler (MN Winkler, 1963) Aktívne centrá pozostávajú z 3-4 aminokyselinových zvyškov. Tyrozín, lyzín, tryptofán a iné boli zistené v ich zložení, a iné. Antbermannants sa nachádzajú, samozrejme, v amino-terminálnych poloviciach Fab fragmentov. Variabilné segmenty pľúc a ťažkých reťazcov sa podieľajú na tvorbe aktívneho centra a tieto patria k hlavnej úlohe. Snáď ľahký reťazec sa len čiastočne zúčastňuje na formácii aktívneho centra alebo stabilizuje štruktúru ťažkých reťazcov. Najkomplexnejší antidenterman je vytvorený iba kombináciou pľúc a ťažkých reťazcov. Čím viac zápasov náhody vzťahu medzi antidentermi protilátkami a determinantmi antigénu, tým vyššia je špecificita. Rôzne špecifickosť závisí od sekvencie aminokyselinových zvyškov v aktívnom stredu protilátok. Kódovanie obrovskej škály protilátok v ich špecifickosti je nejasná. Porter pripúšťa tri schopnosti špecifickosti.
1. Tvorba stabilnej časti imunoglobulínovej molekuly sa monitoruje jedným génom a variabilná časť je tisíce génov. Syntetizované peptidové reťazce sú spojené v molekule imunoglobulínu pod vplyvom špeciálneho bunkového faktora. Antigén v tomto prípade pôsobí ako faktor, ktorý prevádzkuje syntézu protilátok.
2. Molekula imunoglobulínu je kódovaná so stabilnými a variabilnými génmi. Počas delenia buniek dochádza k rekombinácii variabilných génov, čo určuje rôznorodosť ich a variability grafov molekúl globulínu.
3. Gén kódujúci variabilnú časť molekuly imunoglobulínu je poškodená špeciálnym enzýmom. Ostatné enzýmy obnovia poškodenie, ale kvôli chybám umožňujú rôzne sekvencie nukleotidov v tomto géne. To spôsobuje rôzne sekvencie aminokyselín v variabilnej časti imunoglobulínovej molekuly. Existujú napríklad iné hypotézy. Bernet (F. M. Burnet, 1971).
Heterogénnosť (heterogénnosť) protilátok sa prejavuje mnohými pojmami. V reakcii na zavedenie jedného antigénu sa vytvárajú protilátky, ktoré sa líšia v afinite antigénu, antigénnych determinantov, molekulovej hmotnosti, elektroforetickej mobility, N-koncové aminokyseliny. Skupinové protilátky k rôznym mikróbom spôsobujú krížové reakcie na rôzne typy a typy salmonell, Shigell, Escherichia, živočíšnych proteínov, polysacharidov. Vyrobené protilátky sú v ich špecifickosti inhomogénne v porovnaní s homogénnym antigénom alebo jedným antigénnym determinantom. Heterogénnosť protilátky je poznamenáva nielen proti proteínom a polysacharidovým antigénom, ale aj proti komplexu, vrátane konjugovaných, antigénov a antigénov. Predpokladá sa, že heterogénnosť protilátok je určená známym determinantom mikroeterogénnosti antigénu. Heterogenita môže byť spôsobená tvorbou protilátok proti komplexu antigénu - protilátky, ktorá je pozorovaná pri viacerých imunizácii, rozdiely v bunkách tvoriacich protilátky, ako aj protilátku na rôzne triedy imunoglobulínu, ktoré majú komplexné antigénne štruktúra kontrolovaná geneticky.
Typy protilátok
Plné protilátky majú aspoň dve aktívne centrá a pri pripojení k in vitro antigénom spôsobujú viditeľné reakcie: aglutinácia, zrážanie, väzba komplementu; Neutralizuje toxíny, vírusy, španielske baktérie, určujú vizuálny fenomén imunitného lepenia, imobilizácie, opuchových kapsúl, zaťaženie krvných doštičiek. Reakcie prúdia do dvoch fáz: špecifická (interakcia protilátky s antigénom) a nešpecifický (jeden alebo iný z vyššie uvedených javov). Všeobecne sa uznáva, že rôzne sérologické reakcie sú určené jedným a nie mnohým protilátkam a závisia od spôsobov prípravy. Existujú tepelné plné protilátky reagujúce s antigénom pri T ° 37 ° a studenej (kryofilným), vykazujúc účinok pri T ° pod 37 °. Existujú tiež protilátky reagujúce s antigénom pri nízkej teplote a viditeľný účinok sa prejavuje pri t ° 37 °; Jedná sa o dvojfázové, bitermálne protilátky, na ktoré sa pripisuje hemolyzínový donát - Landshtiner. Všetky známe imunoglobulínové triedy obsahujú plné protilátky. Aktivita a špecifickosť sú určené titrom, aviditou (pozri AviDitet), počet Antidentermann. IgM protilátky sú aktívnejšie ako IgG protilátky, v hemolýze a aglutinačné reakcie.
Neúplné protilátky (Nekontrolované, blokovanie, aglutinoidy), ako aj kompletné protilátky, sú schopné spojiť so zodpovedajúcimi antigénmi, ale reakcia nie je sprevádzaná viditeľným in vitro fenoménom zrážania, aglutinácie atď.
Neúplné protilátky sa zistili u ľudí v roku 1944 s antigénom reezs, boli nájdené v vírusových, ricko-a bakteriálnych infekciách vzhľadom na toxíny pri rôznych patologických podmienkach. Existuje množstvo dôkazov o dvoch rue neúplných protilátok. Bakteriálne neúplné protilátky majú ochranné vlastnosti: antitoxické, intersonizujúce, bakteriologické; Zároveň sa zistili neúplné protilátky v množstve autoimunitných procesov - s krvnými ochoreniami, najmä hemolytickou anémiou.
Neúplné hetero- a autoprotilátky sú schopné spôsobiť poškodenie buniek, ako aj hrať úlohu pri výskyte liečiva Leo a trombocytopénia.
Normálne (prirodzené) sa považuje za protilátky, zvyčajne sa vyskytujú v sére zvierat a osoby v neprítomnosti explicitnej infekcie alebo imunizácie. Pôvod antikontaálnych normálnych protilátok môže byť spôsobený najmä antigénnou stimuláciou normálneho telesa mikrofóry. Tieto názory sú teoreticky a experimentálne podložené výskumom živočíšnych nastobionts a novorodencov v bežných biotopoch. Otázka funkcií normálnych protilátok je spojená priamo so špecifickosťou ich pôsobenia. L. A. Zilber (1958) veril, že individuálna odolnosť voči infekciám a navyše "imunogénna ochota tela" je určená ich prítomnosťou. Ukazuje sa úloha normálnych protilátok v krvnej baktericiduáte, pri opsie fagocytózy. Diela mnohých výskumných pracovníkov sa ukázali, že normálne protilátky sú hlavne makroglobulín-MI-IgM. Niektorí výskumníci našli normálne protilátky v IgA- a IgG triedy imunoglobulínov. Vo ich zložení ako nekompletné aj úplné protilátky (normálne protilátky na červené krvinky - pozri krvné skupiny).
Syntéza protilátky
Syntéza protilátky prúdi do dvoch fáz. Prvá fáza indukčná, latentná (1-4 dni), v ktorej nie sú detegované protilátky a bunky protilátok; Druhá fáza je produktívna (začína po indukčnej fáze), protilátky sa nachádzajú v plazmatických bunkách a prúdiaci z kvapalných lymfoidných orgánov. Po prvej fáze tvorby protilátok začína veľmi rýchla rýchlosť protilátok, často ich obsah môže zdvojnásobiť každých 8 hodín a dokonca rýchlejšie. Maximálna koncentrácia rôznych sérových protilátok po jednorazovej imunizácii je registrovaná o 5, 7,10 alebo 15. deň; Po injekcii uložených antigénov - na 21.-30th alebo 45. deň. Ďalej, po 1-3 alebo viac mesiacoch, protilátky prudko klesnú. Niekedy však nízka úroveň protilátok po imunizácii je registrovaná v krvi počas niekoľkých rokov. Bolo zistené, že primárna imunizácia je veľký počet rôznych antigénov, je sprevádzaný vzhľadu ťažkej IgM (19-tych) -Antitel pôvodne, potom počas krátkodobého termínu - IgM a IgG (7S) -Ant-a nakoniec pľúca 7S protilátok. Opätovným stimuláciou senzibilizovaného organizmu je antigén, spôsobuje tvorbu tvorby oboch tried protilátok, skrátenie latentnej fázy tvorby protilátok, syntézu 19S protilátok a prispieva k preferenčnej syntéze 7S protilátok. Často sa vôbec nezobrazujú 19s protilátky.
Výrazné rozdiely medzi induktívnou a produktívnou fázou tvorby protilátok sa nachádzajú v štúdii ich citlivosti na množstvo vplyvov, čo má zásadný význam pre pochopenie povahy špecifickej profylaxie. Je známe napríklad, že ožarovanie s imunizáciou je oneskorené alebo úplne utláčané tvorbou protilátok. Ožarovanie do reprodukčnej fázy protilátky neovplyvňuje obsah protilátok v krvi.
Výber a čistenie protilátok
Aby sa zlepšili spôsob izolácie a čistenia protilátok, boli navrhnuté imunosorbenty. Spôsob je založený na preklade rozpustných antigénov do nerozpustného pripojením kovalentným väzbou na nerozpustnú základňu celulózy, sephadexu alebo iného polyméru. Spôsob umožňuje získať vysoko čistené protilátky vo veľkých množstvách. Spôsob vylučovania protilátok s použitím imunosorbentov obsahuje tri stupne:
1) Extrakcia imunitných sérových protilátok;
2) pranie imunosorbentu z nešpecifických proteínov;
3) Štiepenie protilátok z premyjúceho imunosorbentu (zvyčajne pufrované roztoky s nízkymi hodnotami pH). Okrem tohto spôsobu sú tiež známe ďalšie spôsoby čistenia protilátok. Môžu byť rozdelené do dvoch skupín: špecifické a nešpecifické. Prvým prvkom je disociácia protilátok z komplexného nerozpustného antigénu - protilátky (zrazenina, agglutinat). Vykonávajú sa rôzne látky; Spôsob enzymatického štiepenia antigénu alebo flokulat toxínu - antitoxín amylázy, trypsín, pepsín je rozšírený. Tepelná elúcia sa tiež používa pri T ° 37-56 °.
Nešpecifické metódy purifikácie protilátok sú založené na uvoľnení gama globulínu: elektroforéza v géli, chromatografii na ionomeničových živiciach, frakcionácia gél filtrovanie cez Sephadex. Metóda zrážania je všeobecne známa pre sodík alebo amónium. Tieto metódy sú použiteľné v prípadoch vysokej koncentrácie sérových protilátok, napríklad počas hyperimuncie.
Gelfiltration cez Sephadex, ako aj použitie ionomeničových živíc umožňujú rozdeliť protilátky podľa veľkosti ich molekúl.
Aplikácia protilátok
Protilátky, najmä gama globulíny, sa používajú na terapiu a prevenciu záškrtu, osýpok, tetanu, plynových goggle, sibírskych vredov, leptospirózy, proti stafylokokovým, patogénom besnoty, chrípky atď. Špeciálne pripravené a purifikované diagnostické sérum sa používajú v sérologickej identifikácii Infekcie infekcií (pozri. Identifikácia mikróbov). Zistilo sa, že pneumokoky, stafylococci, salmonela, bakteriofágy atď., Adsorbovanie zodpovedajúcich protilátok priľnú do krvných doštičiek, erytrocytov a iných cudzích častíc. Tento fenomén sa nazýva imunitná adhézia. Ukázalo sa, že v mechanizme tohto fenoménu sa zohrávajú proteínové receptory krvných doštičiek a erytrocytov, ktoré sú zničené trypsínom, papaínom a formalínom. Reakcia imunitnej lepenia závisí od teploty. Zohľadňuje sa priľnavosťou korpuskulárneho antigénu alebo hemaglutinácie spôsobenej rozpustným antigénom v prítomnosti protilátok a komplementu. Reakcia je vysoko citlivá a môže sa použiť na stanovenie komplementu a veľmi malé (0,005-0,01 ug dusíka) množstva protilátok. Imunitné lepenie zvyšuje leukocyty fagocytózy.
Moderné teórie tvorby protilátok
Inštruktívna teória tvorby protilátok sa podľa antigénu rozlišuje antigén priamo alebo nepriamo zapojený do tvorby špecifických imunoglobulínov a teórií zahŕňajúcich tvorbu geneticky konzervačných protilátok na všetky možné antigény alebo bunky, ktoré tieto protilátky syntézy. Patria sem chovné teórie a teóriu represie - drecripty, ktoré umožňujú možnosť syntetizovať s jednou bunkou akýchkoľvek protilátok. Teórie tiež navrhli pochopiť procesy imunologickej reakcie na úrovni holistického organizmu, pričom sa zohľadnia interakcia rôznych buniek a všeobecne akceptované znázornenia o syntéze proteínu v tele.
Priama matricová teória Gaurovitz-Polinging Rozsahuje skutočnosť, že antigén, ktorý prijal vnútri buniek produkujúcich protilátky, hrá úlohu matricu, ktorá ovplyvňuje tvorbu imunoglobulínovej molekuly z peptidových reťazcov, ktorých syntéza prúdi bez účasti antigénu. "Intervencia" antigénu sa vyskytuje len v druhej fáze tvorby proteínovej molekuly - fázy skrútených peptidových reťazcov. Antigén tak mení terminálne N-aminokyseliny budúcej protilátky (imunoglobulínu alebo jeho jednotlivé peptidové reťazce), ktoré sa stávajú komplementárnymi k determinantom antigénu a ľahko vstupujú do kontaktu s ním. Protilátky, ktoré má za následok týmto spôsobom, sa štiepia z antigénu, vstupuje do krvi a uvoľnený antigén sa zúčastňuje na tvorbe nových molekúl protilátok. Táto teória spôsobila množstvo vážnych námietok. Nemôže vysvetliť tvorbu imunologickej tolerancie; Výstupné množstvo protilátok produkovaných bunkou na jednotku času na existujúcej mnohokrát menej ako molekuly antigénu v ňom; Trvanie produkcie protilátok tela vypočítaným rokmi alebo celým životom v porovnaní s výrazne menším obdobím ochrany antigénu v bunkách atď. Malo by sa tiež brať do úvahy, že bunky plazmy alebo lymfoidov, produkujúce Protilátky, nehadzujú antigén, hoci prítomnosť natívneho antigénu alebo jej fragmentov v bunkách snímania protilátok nemožno úplne vylúčiť. Nedávno, Gaurrowitz (F. Haurowitz, 1965) navrhol nový koncept, pre ktorý antigén mení nielen sekundárne, ale aj primárnu štruktúru imunoglobulínu.
Teória nepriamej matice Bernet - fenner Prijatá slávu v roku 1949. Jeho autori sa domnievali, že makromolekula bola antigén a s najväčšou pravdepodobnosťou jeho determinanty prenikli do jadra buniek embryonálneho typu a spôsobujú, že sa v nich spôsobí, že tvorba protilátok k tomuto antigénu je spôsobený. Je povolená analógia medzi opísaným spôsobom a transdukciou v baktériách. Nová kvalita tvorby imunitných globulínov získaných bunkami sa prenáša do potomstva buniek v nespočetných generáciách. Otázka úlohy antigénu v opísanom procese však bola kontroverzná.
Táto okolnosť bola príčinou teórie prirodzeného výberu ERNE (K. Jerne, 1955).
Teória prirodzeného výberu ERNE. Podľa tejto teórie Antigén nie je matricou na syntézu protilátok a nespôsobuje genetické zmeny v produkčných bunkách protilátok. Jeho úloha sa znižuje na výber existujúcich "normálnych" protilátok spontánne vyplývajúcich z rôznych antigénov. Stáva sa to, akoby to bolo také: antigén, biť telo, nájde zodpovedajúcu protilátku, spája k nemu; Odhadovaný antigénový komplex je absorbovaný bunkami, ktoré produkujú protilátky, a druhý prijímajú stimul na produkciu protilátok tohto druhu.
Bernetova klonová teória (F. Burnet) bol ďalší rozvoj myšlienky Eron na výber, ale nie protilátok, ale bunky produkujúce protilátky. Burnet sa domnieva, že v dôsledku všeobecného procesu diferenciácie v embryonálnych a postnatálnych obdobiach mezenchymálnych buniek, mnohých klonov lymfoidných alebo imunologicky kompetentných buniek, schopných reagovať s rôznymi antigénmi alebo ich determinantmi a produkovať protilátky - imunoglobulíny. Povaha reakcie lymfoidných buniek na antigén v embryonálnych a postnatálnych obdobiach sa líši. Zárodok buď nevyrábajú globulíny vôbec, alebo ich trochu syntetizuje. Predpokladá sa však, že hodnoty bunkových klonov, ktoré sú schopné pripojiť sa k reakcii s antigénnymi determinantmi svojich vlastných proteínov, reagujú s nimi a v dôsledku tejto reakcie sú zničené. Takže bunky tvoria anti-a-agglutiníny u ľudí s krvnou skupinou A a anti-in-aglutinínom umierajú - u jedincov so skupinou krvi. Ak embryo zavedie akýkoľvek antigén, potom rovnakým spôsobom zničí Zodpovedajúci klon buniek a novorodenec počas nasledujúceho života je teoreticky tolerantný na tento antigén. Proces zničenia všetkých klonov buniek na svoje vlastné proteíny embrya končí v čase jeho narodenia alebo výstupu z vajca. Teraz novorodenca má len "jeho", a akýkoľvek "cudzinec", ktorý spadol do svojho tela, uznáva. Burnet tiež umožňuje zachovanie "zakázaných" bunkových klonov schopných reagovať s autoántignymi orgánov, ktoré sa počas procesu vývoja izolovali z buniek produkujúcich protilátky. Uznanie "cudzinca" je poskytované zostávajúcimi klonmi mezenchymálnych buniek, na povrchu, z ktorých existujú vhodné antidérinanty (receptory, bunkové protilátky), komplementárny k determinantom "cudzinec" antigén. Povaha receptora sa definuje geneticky, to znamená, že je kódovaná v chromozómoch a nie je uvedená do bunky spolu s antigénom. Prítomnosť hotových receptorov nevyhnutne vedie k reakcii tohto klonu buniek s daným antigénom, ktorý je teraz dva procesy: tvorba špecifických protilátok - imunoglobulíny a reprodukciu buniek tohto klonu. Burtyty predpokladá, že mezenchymálny bunka, ktorý dostal antigénne podráždenie, v poradí mitózy, vedie k populácii dcérskych spoločností. Ak je takáto bunka dedinčanov v mozgovej látke lymfatického uzla, poskytuje tvorbu plazmatických buniek počas sedimentácie v lymfatických folikul - lymfocytoch, v kostnej dreni - eozinofilov. Dcérske bunky sú náchylné na somatické ireverzibilné mutácie. Pri výpočte celého tela môže byť počet mutačných buniek denne 100 LLC alebo 10 miliónov, a preto mutácie zabezpečia klony buniek na akýkoľvek antigén. Bernet teória vzbudil veľký záujem výskumných pracovníkov a veľký počet overovacích experimentov. Najdôležitejšími potvrdeniami teórie boli dôkazom prítomnosti buniek produkujúcich protilátok v predčasne buniek produkujúcich protilátky (lymfocyty produkcie kostí) protilátkami podobných receptorov imunoglobulínu protilátok a prítomnosti interpretového vylúčeného mechanizmu pre protilátky rôznych špecificity v protilátkach.
Teória represie a DRAPERYSCIA formulovaná Silada (L. Szilard) v roku 1960. Podľa tejto teórie, každá bunka produkujúca protilátku môže potenciálne syntetizovať akúkoľvek protilátku k akémukoľvek antigénu, ale tento proces je inhibovaný represorom enzýmu, ktorý sa podieľa na syntéze imunoglobulínu. Na druhej strane, tvorba represora môže byť vykonaná vplyvom antigénu. Soruda sa domnieva, že tvorba protilátok je riadená špeciálnymi netrhanými génmi. Ich číslo dosiahne 10 000 pre každý singel (haploidný) sadu chromozómov.
Lederberg (J. Lemerberg) verí, že v génoch zodpovedných za syntézu globulínov, existujú oblasti, ktoré kontrolujú tvorbu aktívnych protilátok centier. Normálne je funkcia týchto lokalít spomalená, a preto existuje syntéza normálnych globulínov. Pod vplyvom antigénu a možno pod vplyvom niektorých hormónov je zvýšený a stimulujúci aktivity generovaných miest zodpovedných za tvorbu aktívnych centier protilátok a bunka začína syntetizovať imunitné globulíny.
Podľa H. N. Zhukova-Beliegy (1972), evolučné prekurzory protilátok boli ochranné enzýmy podobné tým, ktoré sa objavujú v baktériách s nadobudnutým antibiotikám rezistentným. Podobne ako protilátky, enzýmy sa skladajú z aktívneho (vztiahnuté na substrát) a pasívnych častí molekuly. Kvôli účinnosti, mechanizmus "jeden enzým je jeden substrát" bol nahradený mechanizmom "jednotlivých molekúl s rôznorodosťou časťou", to znamená, že protilátky s variabilnými aktívnymi centrami. Informácie o tvorbe protilátok sú implementované v zóne "rezervných génov", alebo v "redundančnej zóne" na DNA. Takáto redundancia môže byť zdanlivo lokalizovaná v jadrovej alebo plazmidovej DNA, ktorá ukladá "evolučné informácie ..., ktoré zohrávajú úlohu vnútorného mechanizmu," je vysadená "kontrola dedičnej variability". Táto hypotéza obsahuje inštruktívnu zložku, ale nie je plne poučná.
P. F. ZDODOVSKY Vojny antigén úlohu spracovateľa určitých génov, ktoré riadia syntézu komplementárnych protilátok. Zároveň antigén, ako zakázať položky v súlade s teóriou delegácií, otravné adenogipid, čo vedie k somatotropnému (STG) a adrenokortikotropných (ACTH) hormóny. HDS stimuluje reakciu plazmytiky a protilátky, ktorá tvorí tvarovanie lymfoidných orgánov, zase stimulovaná antigénom a ACTH, ovplyvňujúci kôru nadobličiek, spôsobuje kortizón. Toto v imunitnom telesovom telese zničuje reakciu plazmocytov lymfoidných orgánov a syntézy buniek protilátok. Všetky tieto ustanovenia boli experimentálne potvrdené.
Činnosť systému hypofýzov - nadobličiek na produktoch protilátok sa môže detegovať len v pred-imunizovaný organizmus. Je to tento systém, ktorý organizuje anamnestické sérologické reakcie v reakcii na zavedenie do tela rôznych nešpecifických stimulov.
In-hĺbková štúdia bunkových zmien v procese imunologickej odozvy a akumulácie veľkého počtu nových faktov odôvodnil ustanovenie, podľa ktorého sa imunologická reakcia vykonáva len v dôsledku družstevnej interakcie určitých buniek. V súlade s tým sa navrhuje niekoľko hypotéz.
1. Teória spolupráce dvoch buniek. Mnohé fakty boli nahromadené, čo naznačuje, že imunologická odpoveď v tele sa vykonáva za podmienok interakcie medzi rôznymi typmi buniek. Existujú potvrdenie, že makrofágy sú prvé asimilované a modifikované antigénom, ale neskôr "inštruujú" lymfoidné bunky o syntéze protilátky. Zároveň sa ukázalo, že spolupráca a medzi lymfocytmi patriacimi k rôznym subpopuláciám sa vyskytujú: medzi T-lymfocytov (týmusové závislé, antnetereaktívne, vyskytujúce sa z vidlicovej žľazy) a v bunkách (závisí od Thymus závislé, prekurzory protilátkových buniek, lymfocyty kostnej drene).
2. Teória spolupráce troch buniek. Podľa názorov ROYRTT (I. Roitt) et al. (1969) je antigén zachytený a spracovaný makrofágmi. Takýto antigén stimuluje antigén-reaktívne lymfocyty podrobené transformáciám v blancových bunkách poskytujúcich precitlivenosť pomalého typu a transformáciu na dlhotrvajúce imunologické bunky. Tieto bunky prichádzajú do spolupráce s prekurzormi tvoriacimi protilátky, ktoré sú zase diferencované, proliferácie do buniek produkujúcich protilátku. Podľa Richter (M. Richter, 1969) má väčšina antigénov slabú afinitu pre protilátkové bunky, preto je potrebná nasledujúca interakcia procesov: antigén + makrofág - recyklovaný antigén + reaktívny antigén Bunk-aktivovaný antigén + prekurzor protilátky buniek - protilátky. V prípade vysokej afinity antigénu bude tento proces vyzerať takto: antigén + prekurzor protilátkových buniek - protilátky. Predpokladá sa, že za podmienok opätovného stimulujúceho antigénom sa druhý priamo prichádza do styku s bunkou tvoriaci protilátku alebo imunologickú pamäťovú bunku. Toto ustanovenie potvrdzuje väčší rozhlasový rezistencia opakovanej imunologickej reakcie ako primárnej, čo je vysvetlené rôznym rezistenciou buniek zapojených do imunologickej odozvy. Pri postulácii potreby trojnásobnej spolupráce v protissekgeéze, RV Petrov (1969, 1970) sa domnieva, že syntéza protilátky sa vyskytne len vtedy, ak kmeňová bunka (prekurzor protilátkovej bunky) súčasne prijíma recyklovaný antigén z Makrofág a imunopýň induktor z antigén-reaktívnej bunky, vytvorený po ňom (antigén-reaktívna bunková) antigénová stimulácia. Ak sa kontakt kmeňových buniek uskutočňuje len s spracovaným antigénom makrofágov, vytvára imunologickú toleranciu (pozri imunologickú toleranciu). Ak je kontakt kmeňovej bunky oboznámený iba s antigén-reaktívnou bunkou, potom sa vyskytuje syntéza nešpecifického imunoglobulínu. Predpokladá sa, že tieto mechanizmy sú založené na inaktivácii ne-originálnych lymfocytov kmeňových buniek, pretože induktor imunopúčel, ktorý patrí do alogénnej kmeňovej bunky, je antimetabolický (spevák - bunky s identickým genómom, alogénnymi bunkami rovnakého typu iným genetickým zložením).
Alergické protilátky
Alergické protilátky sú špecifické imunoglobulíny vytvorené pri pôsobení alergénov u ľudí a zvierat. Týka sa to krvných cirkulujúcich protilátok v alergických reakciách s okamžitým typom. Tri hlavné typy alergických protilátok sa rozlišujú: senzibilizácia kože alebo reakcia; Blokovanie a hemaglutinovanie. Biologické, chemické a fyzikálno-chemické vlastnosti ľudských alergických protilátok sú zvláštne ( stôl.).
Tieto vlastnosti sa výrazne líšia od vlastností zrážajúcich, protilátok viažucich komplementov, aglutinínov a ďalších opísaných v imunológii.
Reaguje, aby označili homológne ľudské protilátky s senzibilizáciou kože. To je najdôležitejším typom ľudských alergických protilátok, ktorých hlavnou vlastnosťou je schopnosť vykonávať reakciu pasívneho prenosu zvýšenej citlivosti na kožu zdravého príjemcu (pozri Prausnitz-Cunerget reakcia). Reaguje majú rad charakteristických vlastností, ktoré ich odlišujú od relatívne dobre študovaných imunitných protilátok. Mnohé otázky týkajúce sa vlastností reaktorov a ich imunologické povahy zostávajú však nevyriešené. Otázka homogénnosti alebo heterogenity reaktorov je nevyriešená v zmysle ich patriaceho do určitej triedy imunoglobulínov.
Blokovanie protilátok sa vyskytujú u pacientov s pollinzovmi v procese špecifickej hyposenzibilizačnej terapie k tomuto antigénu, ktorý sa uskutočňuje hyposenzibilizáciou. Vlastnosti tohto typu protilátok sa podobajú vlastnostiam zrážajúcich protilátok.
Pod hemaglutinačnými protilátkami sú bežne implikované ľudské a živočíšne sérové \u200b\u200bprotilátky, ktoré sú schopné špecificky aglutinačné červené krvinky, spojené s peľovým alergénom (reakcia nepriamych alebo pasívnych, hemaglutinácie). Väzba povrchu erytrocytu s alergénom peľu sa dosiahne rôznymi spôsobmi, napríklad s pomocou tanínového, formalínu, dvakrát diazotizovaného benzidínu. Hemaglutinating protilátky možno nájsť u ľudí, ktorí majú zvýšenú citlivosť na peľové rastliny, a to ako pred a po špecifickej hyposenzibilizačnej terapii. V procese tejto terapie existuje transformácia negatívnych reakcií na pozitívny alebo zvýšenie titrov hemaglutinálnej reakcie. Genagglutining protilátky majú vlastnosť, ktorá má byť pomerne rýchlo adsorbovaná na erytrocytoch liečených peľovým alergénom, najmä niektorými jeho frakciami. Immunosorbenty odstránia hemaglutinizačné protilátky rýchlejšie ako reagovať. Hemaglutinačná aktivita je spojená s určitým rozsahom a s protilátkami senzibilizačnými kožami, je však úloha protilátok s senzibilizáciou kože v hemaglutinácii, zrejme, je malá, pretože neexistuje žiadna korelácia medzi senzibilizačnými a hemaglutinačnými protilátkami. Na druhej strane existuje korelácia medzi hemaglutinačnými a blokujúcimi protilátkami u ľudí s alergiami na peľové rastliny a zdravým imunizovaným zeleninovým peľom. Tieto dva typy protilátok majú mnoho podobných vlastností. V procese špecifickej hyposenzibilizujúcej terapie sa zvyšuje rovnaký typ protilátok. Gematagglutining protilátky proti penicilínu nie sú identické s protilátkami senzibilizačnými kožami. Hlavnou príčinou tvorby hemaglutinačných protilátok bola penicilinoterapia. Zdá sa, že hemaglutinizačné protilátky by mali byť pripisované skupine protilátok, označovaných ako autori "protilátok svedkov MI-svedkov".
V roku 1962, Shelly (W. Shelley) navrhol špeciálny diagnostický test založený na tzv. Degranulácii organických leukocytov králičieho krvi pod pôsobením alergénu reakcie so špecifickými protilátkami. Avšak povaha protilátok, ktoré sa zúčastňujú na tejto reakcii a spojenie s cirkulujúcimi reaguje, nie sú dostatočne objasnené, hoci existujú údaje o korelácii tohto typu protilátok s úrovňou reaktorov u pacientov s polynózu.
Zriadenie optimálnych pomerov alergénu a testovacieho séra je mimoriadne dôležité z praktických podmienok, najmä v štúdiách s druhmi alergénov, ktoré ešte nie sú obsiahnuté v príslušnej literatúre.
Zvieracie alergické protilátky zahŕňajú tieto typy protilátok: 1) protilátky s experimentálnou anafylaxíou; 2) protilátky v spontánnych alergických ochoreniach zvierat; 3) Protilátky, ktoré zohrávajú úlohu pri vývoji reakcie Artyus (ako je zrážacie). S experimentálnou anafylaxíou, ako spoločné aj lokálne, v krvi zvierat, detegovať špeciálne typy anafylaktických protilátok, ktoré majú majetok pasívne senzibilizovať kožu rovnakého druhu.
Ukázalo sa, že anafylaktická senzibilizácia mravčiacich alergénov Timofeevka Peľovej lúky je sprevádzaná cirkuláciou v krvi koži-senzibilizačných protilátok. Tieto telesá snímania kože majú vlastnosť na vykonanie homológnej pasívnej senzibilizácie kože in vivo. Spolu s týmito homologickými koženými protilátkami, so všeobecnou senzibilizáciou morčiat, alergénov, alergénov Timofeuchea peľu v krvnom obehu protilátok detegovaných reakciou pasívnej hemaglutinácie bis-diazotizovaným benzidínom. Kožie-senzibilizujúce protilátky, ktoré vykonávajú homológny pasívny prenos a majú pozitívnu koreláciu s anafylaxačným indikátorom sa označujú ako skupina homológnych anafylaktických protilátok, alebo homocytotropných protilátok. Použitím termínu "anafylaktické protilátky" im autori pripisujú vedúcu úlohu v anafylaxii reakcii. Štúdie sa začali objavovať potvrdzujúce existenciu homocytopických protilátok proti proteínovým antigénom a konjugátom v rôznych typoch experimentálnych zvierat. Počet autorov identifikuje tri typy protilátok, ktoré sa podieľajú na alergických reakciách s okamžitým typom. Toto sú protilátky spojené s novým typom imunoglobulínu (IgE) u ľudí a podobných protilátok v opice, psoch, králikoch, potkanoch, myšiach. Druhý typ protilátok - protilátkový typ morčiat, schopný upevnených na tukových bunkách a izologových tkanivách. Ďalej sa líšia vedľa vlastností, najmä sú tepelnej stabilnej. Predpokladá sa, že protilátky typu IgG môžu byť druhým typom anafylaktických protilátok. Tretí typ protilátok, senzitizujúcich heterológnych tkanív patriacich, napríklad v mori ošípaných do triedy γ2. U ľudí, len IgG protilátky majú schopnosť senzibilizovať kožu morča.
V prípade chorôb zvierat sú opísané alergické protilátky vytvorené so spontánnymi alergickými reakciami. Tieto protilátky sú termérne, majú vlastnosti senzibilizácie kože.
Neúplné protilátky sa aplikujú pri stanovení antigénov radu izo-osorologických systémov (pozri krvné skupiny), aby sa vytvorili dodávky krvi určitej osobe v prípadoch trestných činov (vraždy, sexuálne trestné činy, dopravné nehody, zranenia atď. ), ako aj preskúmanie kontroverzného otcovstva a materstva. Na rozdiel od kompletných protilátok nespôsobujú aglutináciu červených krviniek v prostredí soľ. Medzi nimi sú rozlišované protilátky dvoch druhov. Prvým z nich je aglutinoidy. Tieto protilátky sú schopné vychovávať červené krvinky v proteíne alebo makromolekulové médium. Druhý typ protilátok - kryptoglutinoidy, ktoré reagujú v nepriamej vzorke Cumbac s antipheammaglobulínovým sérom.
Na prácu s neúplnými protilátkami sa navrhuje niekoľko metód rozdelených do troch hlavných skupín.
1. Metódy konglutinácie. Je potrebné poznamenať, že neúplné protilátky môžu spôsobiť aglutináciu erytrocytov v proteíne alebo makromolekulové médium. Ako takéto prostredie, krvného séra AB (neobsahujúce protilátky), hovädzí albumín, dextrán, biogeny - zvlášť purifikovaný želatín, podávaný tlmivým roztokom na neutrálne pH atď. (Pozri konglutináciu).
2. Metódy enzýmov. Neúplné protilátky sú schopné spôsobovať aglutináciu erytrocytov, vopred ošetrených niektorými enzýmami. Pre takúto liečbu, trypsín, fikín, papaín, extrakty z chleba kvasiniek, gumy, bromelne atď.
3. Vzorka Cumbac s antihyglobulínovým sérom (pozri Cumbas Reakcia).
Neúplné protilátky súvisiace s aglutinoidmi môžu preukázať svoju činnosť vo všetkých troch skupinách metód. Protilátky súvisiace s kryptagglutinoidmi nie sú schopní aglutinovať červené krvinky nielen v roztoku fyziologického roztoku, ale aj v makromolekulové prostredie, ako aj ich blokovať. Tieto protilátky sú otvorené len v nepriamej vzorke CUBSA, s ktorými nielen protilátky týkajúce sa kryptagglutinoidov, ale aj protilátok, ktoré sú aglutinoidy.
Monoklonálne protilátky
Prídavných materiálov, objem 29
Klasický spôsob výroby protilátok na diagnostické a výskumné účely je imunizovať zvieratá s určitými antigénmi a následnou produkciou imunitnej série obsahujúcej protilátky potrebné špecifickosti. Táto metóda má rad nevýhod súvisiacich predovšetkým na skutočnosť, že imunitné séra zahŕňajú heterogénne a heterogénne populácie protilátok, ktoré sa líšia v aktivite, afinitu (afinitu k antigénu) a biologický účinok. Konvenčné imunitné séra obsahujú zmes protilátok špecifických pre obidva vzhľadom na daný antigén a vo vzťahu k kontaminujúcim proteínovým molekulám. Nový typ imunologických činidiel je monoklonálne protilátky získané hybridnými bunkovými klonmi - hybridom (pozri). Nepochybnou výhodou monoklonálnych protilátok je ich geneticky vopred určená štandardná, neobmedzená reprodukovateľnosť, vysoká citlivosť a špecificita. Prvé hybridómy boli zvýraznené na začiatku 70. rokov 20. storočia, ale skutočný vývoj účinnej technológie na vytváranie monoklonálnych protilátok je spojené s Keler a Milpetein Research (G. Kohler, S. Milstein), ktorých výsledky boli publikované 1975-1976. V nasledujúcom desaťročí sa ďalej rozvíjal nový smer bunkového inžinierstva spojeného so získaním monoklonálnych protilátok.
Hybridómy sú vytvorené, keď sú vytvorené lymfocyty hyperimunovaných zvierat s bunkami rôzneho pôvodu. Hybridómy zdedili od jedného z rodičov, schopnosť produkovať špecifické imunoglobulíny a od druhej - nehnuteľnosť je neobmedzená na násobenie. Klonované populácie hybridných buniek môžu produkovať dlhú dobu na produkciu geneticky homogénnych imunoglobulínov špecificity - monoklonálne protilátky. Monoklonálne protilátky produkované hybridómami získanými pomocou jedinečnej myši bunkovej línie Morse 21 (RZ) sú najpoužívanejšie.
Ťažké problémy technológie monoklonálnych protilátok zahŕňajú zložitosť a zložitosť získavania udržateľných vysoko produktívnych hybridných klonov, ktoré produkujú monošpecifické imunoglobulíny; Zložitosť získavania hybridných produkčných monoklonálnych protilátok k slabým antigénom, nie je schopná indukovať tvorbu stimulovaných v lymfocytoch v dostatočnom množstve; Absencia monoklonálnych protilátok určitých vlastností imunitnej série, napríklad vlastnosti za vzniku vyzráža sa s komplexmi iných protilátok a antigénov, na ktorých sú založené mnoho diagnostických testovacích systémov; Nízka frekvencia fúzie lymfocytov, produkujúcich protilátky, s myelómovými bunkami a obmedzenú stabilitu s hybridným hybridom v hmotnostných kultúrach; Nízka stabilita v procese skladovania a zvýšenej citlivosti liekov monoklonálnych protilátok na zmeny pH, inkubačná teplota, ako aj zmrazenie, rozmrazenie a vplyv chemických faktorov; Zložitosť získavania hybridných alebo preložených výrobcov ľudských monoklonálnych protilátok.
Takmer všetky bunky v populácii klonovaného hybridu produkujú monoklonálne protilátky rovnakej triedy a podtriedy imunoglobulínu. Monoklonálne protilátky môžu byť modifikované pomocou metód bunkovej imunitnej techniky. Takže je možné získať "triomy" a "kvadromes", produkujúce monoklonálne protilátky dvojitého špecifickej špecificity, zmenia produkty penta-dimenzionálneho cytotoxického IgM na produktoch pentagene nekótianového IgM, monomérneho nekótianového IgM alebo IgM Znížená afinita, ako aj spínač (so zachovaním antigénnej špecificity) Sekrécia IgM na sekréciu IGD a sekrécia IgGL je na sekrécii IgG2A, IgG2B alebo IgA.
Myský genóm poskytuje syntézu počas 1 x 107 rôznych verzií protilátok špecificky interakcií s epitopami (antigénnym determinantom) proteínu, sacharidov alebo lipidových antigénov prítomných v bunkách alebo mikroorganizmoch. Je možné tvoriť tisíce rôznych protilátok proti jednému antigénu, ktorý sa líši v špecificite a afinitu; Napríklad v dôsledku imunizácie homogénnymi ľudskými bunkami sa indukuje až 50 000 rôznych protilátok. Hybridné použitie umožňuje vybrať takmer všetky varianty monoklonálnych protilátok, ktoré môžu byť indukované na tento antigén v experimentálnom zvierati.
Rozmanitosť monoklonálnych protilátok, získaných na rovnaký proteín (antigén), určuje potrebu určiť ich tenšiu špecifickosť. Charakteristiky a výber imunoglobulínov s požadovanými vlastnosťami medzi mnohými typmi monoklonálnych protilátok interakcií s testovacím antigénom sa často konvertujú na viac časovo náročnú experimentálnu prácu ako získanie monoklonálnych protilátok. Tieto štúdie zahŕňajú separáciu sady protilátok na skupiny špecifické pre jeden alebo iný epitopam, po ktorom nasleduje výber v každej skupine optimálnej verzie afinity, stability a iných parametrov. Na stanovenie špecifickosti epitopu sa najčastejšie používa metóda konkurencieschopného enzýmového imunotestu.
Vypočíta sa, že primárna sekvencia 4 aminokyselín (normálna veľkosť epitopu) sa môže vyskytnúť až 15-krát v aminokyselinovej sekvencii proteínovej molekuly. Krížové reakcie s monoklonálnymi protilátkami sú však pozorované s oveľa menšou frekvenciou, ako sa dalo očakávať, na základe týchto výpočtov. To sa stane, pretože nie všetky tieto oblasti sú vyjadrené na povrchu proteínovej molekuly a sú rozpoznané protilátkami. Okrem toho monoklonálne protilátky detegujú aminokyselinové sekvencie len v určitej konformácii. Skutočnosť, že sekvencia aminokyselín v proteínovej molekule nie je distribuovaná medzi proteínovú molekulu a časti viažuce protilátky sú oveľa väčšie ako minimálny epitop obsahujúci 4 aminokyseliny.
Použitie monoklonálnych protilátok otvorilo neprístupné príležitosti na štúdium mechanizmov funkčnej aktivity imunoglobulínov. Prvýkrát, s pomocou monoklonálnych protilátok, bolo možné identifikovať antigénne rozdiely v proteínoch, predtým sérologicky nerozoznateľné. Medzi vírusmi a baktériami boli vytvorené nové podtypy a kmeňové rozdiely, boli otvorené nové bunkové antigény. S pomocou monoklonálnych protilátok sa medzi štruktúrami zistilo, že existencia, ktorej existencia bola nemožná spoľahlivo dokázať s použitím polyklonálnych (obyčajných imunitných) sérov. Použitie monoklonálnych protilátok umožnilo identifikovať konzervatívne antigénne determinanty vírusov a baktérií so širokou skupinou špecificitou, ako aj epitopy špecifické pre kmeňové, charakterizované veľkou variabilitou a variabilitou.
Detekcia antigénnych determinantov s monoklonálnymi protilátkami antigénnych determinantov, ktoré indukujú produkciu ochranných a neutralizačných protilátok proti pôvodcom infekčných ochorení, je dôležité pre tvorbu lekárskych a profylaktických liekov. Interakcia monoklonálnych protilátok s vhodnými epitopami môže viesť k staterickom (priestorových) prekážkach, ktoré sa vyskytujú pre funkčnú aktivitu proteínových molekúl, ako aj altoherektívnych zmien, ktoré prevádzajú konformáciu aktívnej časti molekuly a blokujú biologickú aktivitu proteín.
Len s pomocou monoklonálnych protilátok bolo možné skúmať mechanizmy kooperatívneho účinku imunoglobulínov, vzájomnej potenciácii alebo vzájomnej inhibícii protilátok zameraných na rôzne epitopamy rovnakého proteínu.
Na výrobu hromadných množstiev monoklonálnych protilátok sa často používajú askitové nádory myší. Cermatizované lieky monoklonálnych protilátok môžu byť získané na neald-voľnom médiu vo fermentovaných suspenzných kultúrach alebo v dialyzačných systémoch, v mikrokapsulovaných kultúrach a typy kapilárnych kultúr. Na získanie 1 g monoklonálnych protilátok sa vyžaduje približne 0,5 litra askitickej tekutiny alebo 30 1 kultivačnej tekutiny inkubovanej vo fermentoroch so špecifickými hybridómovými bunkami. Vo výrobných podmienkach produkujú veľmi veľké množstvá monoklonálnych protilátok. Významné náklady na produkciu monoklonálnych protilátok sú odôvodnené vysokou účinnosťou purifikácie proteínov na imobilizovaných monoklonálnych protilátok a koeficient purifikácie proteínu v jednostupňovej tvorbe afinné chromatografie dosahuje niekoľko tisíc. Affinovaná chromatografia založená na monoklonálnych protilátok sa používa pri čistení rastového hormónu, inzulínu, interferónu, interleukínov produkovaných zmenenými metódami genetických inžinierskych kmeňov baktérií, kvasiniek alebo eukaryotických buniek.
Použitie monoklonálnych protilátok v diagnostických súprav sa rýchlo vyvíja. Do roku 1984 sa na klinické štúdie odporúča približne 60 diagnostických testovacích systémov pripravených použitím monoklonálnych protilátok. Hlavné miesto medzi nimi je obsadené testovacími systémami na včasnú diagnózu tehotenstva, určujúc obsah hormónov v krvi, vitamíny, liečivách, laboratórnych trendov infekčných ochorení.
Kritériá na výber monoklonálnych protilátok sú formulované na ich použitie ako diagnostické činidlá. Patrí medzi ne vysoká afinita k antigénu, poskytujúc väzbu pri nízkej koncentrácii antigénu, ako aj účinnú súťaž s hostiteľskými protilátkami, ktoré už súvisia s antigénmi v štúdii vzorky; Smer antigénnej časti zvyčajne nie je rozpoznaný hostiteľskými protilátkami hostiteľským organizmom, a preto nie sú maskované týmito protilátkami; Orientácia proti opakovaným antigénnym determinantom povrchových štruktúr diagnostikovaného antigénu; Poloivalencia, ktorá poskytuje vyššiu IgM aktivitu v porovnaní s IgG.
Monoklonálne protilátky môžu byť použité ako diagnostické prípravky na stanovenie hormónov a liečiv, toxických zlúčenín, markerov malígnych nádorov, pre klasifikáciu a počítanie leukocytov, presnejšie a rýchlo určujúce príslušnosť krvnej skupiny, na identifikáciu antigénov vírusov, baktérií najjednoduchších, pre Diagnóza autoimunitných ochorení, detekciu autoprotilátok, reumatoidných faktorov, stanovenie tried imunoglobulínu v sére.
Monoklonálne protilátky nám umožňujú úspešne odlíšiť povrchové štruktúry lymfocytov a s veľkou presnosťou na identifikáciu hlavných subyouls lymfocytov, klasifikovať do rodiny leukémie buniek a ľudskej lymfy. Nové reagencie na základe monoklonálnych protilátok uľahčujú postup určovania B-lymfocytov a T-lymfocytov, podtried T-lymfocytov, otočení do jedného z jednoduchých štádií počítania vzorca krvi. S pomocou monoklonálnych protilátok je možné zvoliť jednu alebo inú subpopuláciu lymfocytov, vypnúť zodpovedajúcu funkciu bunkového imunity systému.
Typicky, diagnostické prípravky na báze monoklonálnych protilátok obsahujú imunoglobulíny značené rádioaktívnym jódom, peroxidázou alebo iným enzýmom používaným v imunoasfónových reakciách, ako aj fluorochrómoch, napríklad fluoresceiniciacian, ktoré sa používajú v imunofluorescenčnej metóde. Vysoká špecificita monoklonálnych protilátok je zvláštna hodnota pri tvorbe zlepšených diagnostických prípravkov, zvýšenie citlivosti a špecificity rádioimunoho logického, imunofementácie, imunofluorescenčných metód sérologickej analýzy, rozptýlenia antigénov.
Terapeutické použitie monoklonálnych protilátok môže byť účinné, ak je to potrebné na neutralizáciu toxínov rôznych pôvodov, ako aj antigenátových jedov, na dosiahnutie imunosupresie v transplantácii orgánov, na indukciu komplementárnej cytolýzy nádorových buniek, na korekciu kompozície T-lymfocytov a imunoregulácie , Na neutralizáciu baktérií udržateľných antibiotík, pasívnej imunizácie proti patogénnym vírusom.
Hlavnou prekážkou pre cesty terapeutického použitia monoklonálnych protilátok je možnosť vývoja nepriaznivých imunologických reakcií spojených s heterológnom pôvode monoklonálnych imunoglobulínov. Na prekonanie, je potrebné získať ľudské monoklonálne protilátky. Úspešné štúdie v tomto smere umožňujú použitie monoklonálnych protilátok ako vektory pre cielené dodávanie kovalentne súvisiacich liekov.
Vyvinie sa terapeutické prípravky, špecifické pre prísne definované bunky a tkanivá a majú cielenú cytotoxicitu. To sa dosahuje konjugáciou high-tech proteínov, napríklad difterického toxínu, s monoklonálnymi protilátkami rozpoznávajúcimi cieľové bunky. Sme vedených monoklonálnymi protilátkami, chemoterapeutickými činidlami sú schopné selektívne zničiť nádorové bunky nesúce špecifický antigén v tele. Monoklonálne protilátky môžu vykonávať úlohu vektora a pri zapustení do povrchových štruktúr lipozómu, ktorý poskytuje dodávanie orgánov alebo cieľových buniek významných množstiev liekov uzavretých v lipozómoch.
Konzistentné použitie monoklonálnych protilátok nebude len zvýšiť informativity konvenčných sérologických reakcií, ale tiež pripraví vznik zásadných nových prístupov k štúdiu interakcie antigénov a protilátok.
|
Parametre v štúdii |
Typy protilátok |
||
|
senzibilizácia kože (reagovať) |
blokovanie |
gemAgluting |
|
|
Princíp definície protilátok |
Odozva alergénu |
Blokovanie reakcie alergénu |
Reakcia nepriamych hemaglutinácie v testovacej trubici |
|
Odolnosť pri T ° 50 ° |
Termolábium |
Termostaný |
Termostaný |
|
Schopnosť prejsť placentou |
Neprítomný |
Neexistujú žiadne údaje |
|
|
Schopnosť uložiť 30% síran amónium |
Nezrážajte sa |
Záloha |
Čiastočne vyzrážané, čiastočne zostať v roztoku |
|
Chromatografia na Deee -celulóza |
Rozptýlené v niekoľkých frakciách |
V 1. frakcii |
V 1. frakcii |
|
Absorpcia imuno-sorbentov |
Spomaliť |
Neexistujú žiadne údaje |
|
|
Odrazenina s peľovými alergénmi |
Nie, ani po koncentrácii protilátok |
Po koncentrácii protilátok je po koncentrácii protilátok |
Zrážacia aktivita sa nezhoduje s hemaglutináciou |
|
Inaktivácia merkaptánov |
Vyskytuje |
Nedeje sa |
Neexistujú žiadne údaje |
|
Rozdelenie papaínu |
Spomaliť |
Neexistujú žiadne údaje |
|
|
Konštantná sedimentácia |
Viac ako 7 (8-11) S |
||
|
Elektroforetické vlastnosti |
Hlavne γ1-globulíny |
y2-globulíny |
Najviac spojené s y2 globulin |
|
Trieda imunoglobulínu |
|||
Bibliografia
Bernet F. Celková imunológia, na. \\ T Od angličtiny, M., 1971; Gaurova C F Immunoochémia a biosyntéza protilátky, na. Od angličtiny, M., 1969, BiBLIGR.; Dossa J. Immunohematológia, na. z Franz., M., 1959; Zdodovsky P. F. Problémy infekcie, imunity a alergií, M., 1969, BiBLLIGR.; Immunoichi-Mics, Ed. L. A. Zilber, str. 21, M., 1968; Cabot E. a Meyer M. Experimentálna imunochémia, na. Od angličtiny, M., 1968, BiBLIGR.; Nezlin R.S. Štruktúra biosyntézy protilátky. M., 1972, BiBLIGR.; Nos l protilátok a imunitu, na. Od angličtiny, M., 1973, BiBLIGR.; Petrov R.V. Formy interakcie geneticky odlišných buniek lymfoidných tkanív (trojbložkový systém imunogenézy), hore. Sovr. Biol., Vol. 69, v. 2, s. 261, 1970; Uteshev B. S. a Babichev V. A. Inhibítory biosyntézy protilátok. M., 1974; Efroimson V. P. Immunogenetics, M., 1971, BiBLIGR.
Alergický A. - ADO A. D. ALERGY, MULTICAM. Pat. Fiológia, ed. H. N. Sirotinin, t. 1, str. 374, M., 1966, BiBLIGR.; ADO A. D. Všeobecná alergológia, str. 127, M., 1970; POLNER A. A. A., VERMONT I. E. IZERSOVA T. I. O PROBLÉMOU IMUNIKOU PRÍROČNOSTI REAKCIÍ NA KNIHUJÚCEJ AULINÓZU, V KNIKU: Problém. Alergol., Ed. A. D. ADO A A. A. PODKOLZINA, s. 157, M., 1971; Bloch K. J. Anafylaktické protilátky cicavcov vrátane človeka, prognózy. Alergia, v. 10, str. 84, 1967, BIBLLIGR.; Ishizaka K. a. Ishizaka T. Význam imunoglobulínu E v reaginickej precitlivenosti, Ann. Alergia, v. 28, s. 189, 1970, BiBLLIGR.; Lichtenstein L. M., Levy D. A. A. Ishizaka K. in vitro reverzná anapylaxia, charakteristiky uvoľňovania histamínu anti-IgE, imunológie, V. 19, s. 831, 1970; Sehon A. H. Heteregénnosť protilátok v alergickej sére, v knihe: Molec. a. Bunkový základ tvorby protilátok, ED. J. Sterzlom, s. 227, Praha, 1965, BiBLIGR.; Stanworth D. R. Imunochemické mechanizmy reakcií precitlivenosti okamžitého typu, Clin. Exp. Immunol., U. 6, str. 1, 1970, BiBLIGR.
Monoklonálne protilátky - Hybridómy: Nová úroveň biologickej analýzy ED. R. G. KENNET a kol., M., 1983; Rokhlin O. V. Monoklonálne protilátky v biotechnológii a medicíne, v knihe: biotechnológia, ed. A. A. BAEVA, s. 288, M., 1984; N o w i n s k i r. C. a. o. Monoklonálne protilátky pre diagnostiku infekčných chorôb u ľudí, vedy, V. 219, s. 637, 1983; Olson L. monoklonálne protilátky v klinickej imunobiológii, derivácii, potenciáli a obmedzení, alergii, v. 38, s. 145, 1983; Sinko Vies J. G. A. D R E E E S M A N G. R. Monoklonálne protilátky hybridómov, Rev. Infikovať. DIS., V. 5, s. 9, 1983.
M. V. Zemskov, H. V. Zhuravleva, V. M. Zemskov; A. A. Poľner (všetko); A. K. TUMANOV (COUT); A. S. Novokhatsky (monoklonálne protilátky).
Alergické protilátky sú veľkou skupinou ľudského a živočíšnu globulín. Najdôležitejšie rozdiely medzi protilátkami z "normálneho" globulínu sú ich imunologická špecificita a biologická schopnosť spôsobiť určité alergické reakcie.
Mnohé imunitné protilátky majú vlastnosti alergických protilátok. Napríklad antitaxíny pre bakteriálne exotomíny sa podieľajú na anafylaktickom šoku mechanizmu spôsobeným týmito toxínymi ("toxická anafylaxia" v I. V. MORGUNOV, 1963, atď.), Lyzín a komentáre viazané protilátky spôsobujú alergické reakcie "inverzný typ", alergický "citotoxický »Šok a rôzne alergické reakcie cytolýzy (forssmer, 1911; Waksman, 1962).
Širokopásmová skupina alergických reakcií je spôsobená protilátkami typu precipitídy a agglutinínov; Artus fenomén, OREE fenomén, anafylaktický šok na králiku, sérové \u200b\u200bochorenia, liečivá alergie (Artlius, 1903; Pirquet, 1907; Ovary, 1958). Medzi protilátkami tejto skupiny, takéto typy priquses a aglutinínov sú tiež zapojené do mechanizmu alergických reakcií, ktoré neboli nájdené v konvenčných metódach, priamom makro a mikrojlutinácii atď., Ktoré boli nájdené v krvi ľudí so sérom alebo Zvieratá v krvi ľudí so sérom alebo zvieratami. Pri anafylaktickej senzibilizácii po odstránení zrazín z krvi, špecifický antigén. Krvné sérum Po odstránení zrazín si zachoval schopnosť pasívne prenášať stav všeobecnej alebo lokálnej anafylaxie. Richefc (1907) a potom Friedberger (1909) nazývali tieto protilátky anafylaktické.
V budúcnosti sa v štúdii o viacerých formách alergických ochorení (polyness, "atopické" ochorenia, imutematologické ochorenia), špeciálne typy alergických protilátok boli odhalené. Niektoré z nich našli vlastnosti precipitínov alebo aglutinínov len za osobitných podmienok alebo špeciálnou technikou ich detekcie (reakcia ko-recitácia, aglutinácia erytrocytov liečených pre-tanín atď.). Tieto alergické protilátky sú známe ako "Ienrecinimimbing" ("Nedokončené"), alergické studené agglutinins atď.
Táto skupina alergických protilátok zaberá strednú polohu medzi plnohodnotnými zrážkami a agglutinami a skupinou alergických protilátok, čo spôsobuje senzibilizáciu kože zdravého človeka po podaní, V. Sérum pacienta pacienta polovica "
priblíženie iného typu alergie okamžitého (chimergického) "typu (alergia na plesňovanie, prach, potraviny a iné alergény). Posledný typ protilátok SOSA (1925) nazývaný" reaguje ", alebo" atoppy "(priezvisko nebolo ). Biologické a fyzikálne chemické vlastnosti reaktorov sa významne líšia od vlastností všetkých známych imunitných protilátok.
Úplne zvláštne protilátky zapojené do mechanizmu alergických reakcií pomalého typu a niektorých okamžitých alergických reakcií sú takzvané tkaniny alebo bunkové, fixné, "predstierané" protilátky. Vlastnosti a mechanizmus účinku týchto protilátok ešte nie sú dostatočne študované. Mnohé typy protilátok sa teda podieľajú na mechanizmoch rôznych alergických reakcií, v rozmedzí od protilátok s biologickými a fyzikálno-chemickými vlastnosťami imunitného a končiace so špeciálnymi typmi protilátok, ktoré nemajú nič spoločné s protilátkami, ktoré spôsobujú imunitné reakcie.
Všetky alergické protilátky môžu byť rozdelené do dvoch veľkých skupín. Prvá skupina zahŕňa krvné protilátky a iné biologické tekutiny (humorálne protilátky), do druhej skupiny - protilátky sediacich baleniami - tkaninou, pevnou alebo "zahrievanou" (bunkové protilátky). Posledná skupina protilátok by nemala byť zamieňaná s humorálnymi protilátkami, druhým pevným PA buniek hladkých svalov, na iných tkanivách s pasívnym anafylaxiam a alergie s okamžitým typom (reakcia Schultz - Dale, pasívna koža anafylaxie - OREE fenomén, pasívny anafylaktický šok atď. ,).).
Vzťah rôznych typov alergických protilátok môže byť reprezentovaný ako nasledujúca schéma (schéma 7).
C h e m a 7
Interakcia rôznych typov alergických protilátok alergických protilátok
"Pevná pevná (bunka)
Pr o d iptnersuting ne as teli
Blokovanie blokovania kože (ochranné protilátky)
(reagovať)
Biologické a fyzikálno-chemické vlastnosti normálnych a imunitných globulínov ľudských a živočíšnych krvných sérov sú v pozornosti moderných biochemistov a imunológov.
Pozrite sa na protilátky, vrátane alergických, as. Na zmenených globulínoch krvi vyvinuté v našej krajine, V. A. Barykin (1927), N. F. GAMALEY (1928) vo forme imunity doktríny ako funkcie koloidného stavu krvných proteínov (VA Barykip) alebo vo forme teórie výtlačkov (NF GAMALEI), vyvinutý Pauling a Hrowitz a mnoho ďalších imunológov.
Humorálne alergické protilátky spolu s imunitnými protilátkami sú veľká rodina globulínov, ktoré dostali majetok konkrétne na pripojenie s najrôznejšími alergénmi,
spôsobené tvorbou alebo so spoločným určením skupín s nimi. Podľa Grabára (1963) protilátky imunitné aj alergické expresiu s fyziologickou dopravnou funkciou transportnej funkcie krvného globulínu v rovnakom rozsahu, ako je známe, že prenesie sacharidové globulín (glykoproteíny), lipoidy (lipoproteíny) a iné látky. Samozrejme, v prípadoch protilátok, táto transportná funkcia prijíma súčasne vysoký stupeň imunologickej špecificity, ktorá poskytuje protilátky s ich ochrannými alebo pohlavnými vplyvmi.
Špecifickosť niektorých alergických protilátok je relatívna. V senzibilizácii králikov v jednom type peľových rastlín vznikajú protilátky mnohým typom alergénov peľu (A. D. Ledo et al., 1963). Na klinike Pollipozov sa zvyčajne pozoruje polyvalentná citlivosť na mnoho typov peľ stromov a bylín. Pod ochorením v sére je reumatizmus pozorované protilátky, aglutinačné a lysiring erytrocyty RAM (heterofilné protilátky), ako aj vyzráža na krvné proteíny mnohých typov cicavcov (králika, mačka, pes, potkan, myš atď.).
Cooke a Sherman (1940) v pasívnej prevodnej reakcii zafarbili možnosť reagovať na alergické protilátky s mnohými alergénmi. S imunizáciou králičieho séra RAM sa tiež formuje aj pre ľudské krvné proteíny, kone a ošípaných (Landsteiner, Van Sclicer, 1939, 1940).
Alergická reakcia Imunitná reakcia rozlišuje poškodenie vlastných tkanív. Zápal s hyericigickým charakterom, opuchom, bronchospazmom, kožným svrbením, cytotoxickými a cytolitickými účinkami, šok - všetky tieto klinické príznaky alergickej reakcie sú expresím poškodenia spôsobeného imunitným mechanizmom [Pyzkom V.I. a kol., 1984]. Jedným z charakteristických znakov alergického ochorenia sú produkty alergických protilátok. V štúdii alergických ochorení (polyinómie, "atopické" choroby, imunohemické ochorenia atď.) Boli nájdené niekoľko funkčne odlišných alergických protilátok. Vzťah rôznych typov alergických protilátok podľa A. D. ADO (1970) je uvedený v schéme 1:
Podľa klasifikácie A. D. ADO sú alergické protilátky rozdelené do dvoch skupín: krvné protilátky a iné biologické tekutiny (humorálne protilátky) a tkanivové protilátky (pevné, "sessile", bunka). Alergické protilátky, ako aj imunitné, patria do imunoglobulínov. Majú nehnuteľnosť, aby sa konkrétne spojili s alergénmi, ktoré spôsobili svoje vzdelanie alebo majú spoločné determinantové skupiny [ADO A. D., 1970]. Existuje päť typov imunoglobulínov, odlišných fyzikálno-chemických vlastností: IgG, IgA, IgM, IGD, IgE.
Alergické protilátky (reagujú) V podstate sa týkajú piateho typu imunoglobulínu - IgE, ale medzi nimi existujú obe hodiny reaguje s koeficientom sedimentácie približne 7. Predpokladá sa, že LGE sa syntetizuje v lymfoidnom tkanive slizníc a lymfatických uzlín, kvôli šoku Orgány s reaktívnym typom reakcie sú respiračné orgány, črevá, konjunktiv. Reakčný typ reakcie podkladí atopické ochorenia (atopická dermatitída, polynóza, bronchiálna astma atď.). Reaktivujte alebo kožné senzibilizujúce protilátky, zistené v sére pacientov s okamžitým typom precitlivenosti a majú schopnosť senzibilizovať kožu, ako aj sliznicu nosa, oka, dýchacích ciest, ktorý sa stanoví pomocou alergických testov .
Vzhľad blokujúcich protilátok definovaných v RPGA je spôsobený ochranným faktorom z škodlivého účinku alergénu. Úloha blokovania alergických protilátok však nebola úplne študovaná. Zrážajúce alergické protilátky sa podieľajú na imunokomplexnej patológii, viazanie a viazanie komplementu - v alergických reakciách rôznych typov (tuberkulínu, anafylaktické, s polovičným starým, ekzémom).
A alergická reakcia sa spravidla zapojí nielen in-, ale aj efektorové T-lymfocyty. Prevažujúci vývoj reakcie v jednom smere alebo iný smer je do značnej miery určený dávkou, chemickou štruktúrou a fyzikálno-chemickým stavom antigénu. V dôsledku vplyvu alergénu a intercelulárnych interakcií dochádza k aktivácii lymfocytov, ktorá je sprevádzaná ostrými biochemickými zmenami. Predtým sú zaznamenané v bunkovej membráne: ich priepustnosť sa zvyšuje pre mnohé látky, aktivita cyklov, ktorá reguluje hladinu cyklického nukleotidového cyklického adenozínmonofosfátu (CAMF) a cyklického monofosfátu guanozínu (CGMF) sa zvyšuje. Prevalencia prvého určuje prevalenciu procesu dozrievania buniek, prevaha druhej znamená zvýšenie bunkovej delenia. Početné biochemické zmeny sa tiež zaznamenávajú v cytoplazme, granulách a bunkovej jadre. Spôsob aktivácie syntézy lymfocytov v DNA buniek je dokončený, syntéza RNA a proteínu je zvýšená.
Efektívne T-lymfocyty (T-vrah) vylučujú mediátory, ktoré určujú svoj biologický účinok (napríklad lymfotoxíny). Významné zmeny sa týkajú ich membrány: obsah na ich povrchu niektorých makromolekúl sa mení, niektoré značky zmiznú, iné sa objavujú. T-Killers nestrácajú receptory pre antigén: sú potrebné rozpoznať cieľové bunky, ku ktorým ovplyvňujú.
Medzi bunkovými mechanizmami cytolýzy, cytotoxicita v dôsledku imunitných T-vrahov bola najviac študovaná. Cytolýza T-buniek sa skladá z niekoľkých krokov: Zriadenie kontaktu medzi vrahom a cieľovou bunkou (táto fáza je reverzibilná - separácia buniek zabraňuje smrti cieľových buniek), naprogramovanej lýze (cieľová bunka vyzerá životaschopné, ale je odsúdený na smrť) a dokončenie lýzy. Cieľové bunky usmrtené jedným z menovaných mechanizmov sú eliminované makrofágmi a inými fagulokovacími bunkami.
- Mechanizmus vývoja alergických ochorení závisí od účasti rôznych alergických protilátok a T-lymfocytov-efektorov. A. D. ADO Všetky alergické reakcie rozdeľujú na skutočné alebo vlastne alergické, a nepravdivé alebo pseudo-alergické (neimunologické). TRUE, ALEBO ALERGETICKÝCH AKTOROM, AUTOR DIEVČATEĽA CHIMERGICKÝ (IN-ENVENTNAL) A CYTERGICKÝ (T-Dependent). Najväčšou distribúciou v alergológii bola klasifikácia GELLA - CUMSA, v súlade, s ktorou by sa mali rozlíšiť alergické reakcie:
- Typ I - anafylaktický, v ktorom sú zahrnuté IgE- a menej často IgG4 protilátky;
- Typ II - Cytotoxický s účasťou IgG a IgM protilátok počas adsorpcie alergénu na cieľových bunkách;
- III Typ (typ Artus) - Poškodenie imunitného komplexu s účasťou protilátok IgG a IgM;
- IV typu - spomalená precitlivenosť implementovaná T-lymfocytmi.
Mechanizmus alergického reakcie typu pomalého typu Skladá sa z nasledujúceho: Keď sú alergén hit, senzibilizované lymfocyty sú tvorené do tela. Sú to T-populácie lymfocytov, ktoré majú štruktúrne štruktúry zabudované do membrány, ktorá hrá úlohu protilátok a je schopný spojiť sa k antigénu. Opakovane prenikajú do tela, alergén je pripojený k senzibilizovaniu lymfocytov, čo vedie k aktivácii a proliferácii buniek, zvýšenie syntézy DNA a RNA, sekréciu lymfokínových mediátorov. Niektoré lymfokíny prispievajú k mobilizácii rôznych buniek, iných (s chemotaktickou aktivitou) - aktivovať chemotaxiu makrofágov, polymorfných jadrových buniek do umiestnenia alergénu. Pod vplyvom iných mediátorov sa oneskoria na tomto mieste, ich fagocytová aktivita sa zvyšuje. Okrem toho lymfokíny majú cytotoxickú, inhibičnú aktivitu účinku buniek. Priamy cytotoxický účinok na cieľové bunky môžu mať lymfocyty-vrah. Na mieste, kde sa vyskytne almfocytová zlúčenina s alergénom, adsorbované bunky, zničenie týchto buniek, po ktorých nasleduje fagocytóza bunkového otca a permeability plavidiel sa zvyšuje, t.j. obraz zápalovej odozvy produktívneho typu sa vyvíja.
Imunologický štádium precitlivenosti Pomalý typ je charakterizovaný aktiváciou systému závislého od thymusu. Senzibilizované lymfocyty v zaostrení alergického reakcie je 1-2%. Zostávajúce bunky z nesensentylizovaných priťahovaných spôsobených pôsobením lymfokínov. Postichimický štádium IV typu alergického reakcie je charakterizovaný uvoľňovaním mediátorov - lymfocyny v dôsledku interakcie T- a B lymfocytov s alergénmi. Najviac študoval nasledujúce lymfokíny:
- 1. Faktor v depresívnej migrácii makrofágov (mýtu) prispieva k akumulácii makrofágov v oblasti alergickej, zlepšuje ich aktivitu a fagocytózu.
- 2. Faktor, ktorý stimuluje tvorbu endogénneho pyrogénu.
- 3. Mitogénne faktory: lymfocytový mitogénny faktor (LMF), interleukín 1 makrofágov pôvodu a interleukín 2 zvýraznený T-HELLERS.
- 4. Chemotaxický faktor vedúci k chemotaxii vhodných leukocytov (makrofágov, neutro-filter, bazofilných a eozinofilných granulocytov).
- 5. Lymfotoxíny, ktoré spôsobujú poškodenie alebo zničenie rôznych cieľových buniek.
- 6. Faktor reaktívny s pokožkou, na ktorom závisí závažnosť zápalu. Zníženie výberu kože reaktívneho faktora krvných lymfocytov hovorí o útlaku bunkovej imunity.
- 7. Prenos faktor vysielania "imunologická pamäť" na senzibilizujúce alergén.
V poškodení pôsobenia, okrem mediátorov lymfocytov a makrofágov, lizosomálnych enzýmov, knínov a iných systémov.
Patofyziologický stupeň alergickej reakcie Pomalé účinky sa vyznačuje škodlivým účinkom senzibilizovaných lymfocytov na cieľovej bunke. Cytotoxický účinok T-lymfocytov je možné prostredníctvom lymfotoxínu nepriamo, ako aj v dôsledku uvoľňovania lyzozomálnych enzýmov v procese fagocytytózy.
Mediátory patchimického štádia alergickej reakcie IV typu formy zápal, ktorý je na jednej strane ochranný faktor, na strane druhej, faktor poškodenia, porušenie funkcie tohto orgánu, kde sa vyvíja.
S alergickými reakciami okamžitého typu je potrebné zachovať humorálne protilátky, ktoré sú proteíny typu a sú spojené len so špecifickými antigénmi. Komplex antigén - protilátka spôsobuje rôzne poškodenie v tele. Rozpustné antigény najčastejšie spôsobujú reakciu zrážania; Antigény vo forme erytrocytov, baktérií, vírusov, koloidných častíc so zlúčeninou so špecifickými protilátkami - reakciou aglutinácie. Na detekciu protilátok v imunológii sa používajú rôzne reakcie.
Protilátky sú produkované lymfoidnými bunkami lymfatických uzlín, sleziny, kostnej drene, mandlí. Môžu byť nájdené v krvi za 7-15 dní po podaní alergénu. Maximálna hladina protilátok je pozorovaná v krvi niekoľko týždňov a ďalšie, potom sa produkty protilátok znižujú a môžu byť detegované v krvi v minimálnej množstvách niekoľko mesiacov. Priemerná dĺžka života protilátok cirkulujúcich v krvi je 20 dní; To označuje dlhú syntézu ich imunokompetentných buniek.
Protilátky patria k globulínom krvi. Väčšina novorodencov globulínov je veľmi malá - majú absenciu protilátok. Počas niekoľkých týždňov po narodení existuje zvýšenie krvného globulínu a paralelne zvyšuje hladinu protilátok.
Novorodenca má hladiny gama-globulínu na normálne, avšak väčšina z týchto gama-globulínov je materská. Obsah gama globulínov sa znižuje počas prvých dvoch mesiacov života, pretože jeho vlastné výrobky globulínov sú mimoriadne slabé. Iba v treťom mesiaci života dosahujú produkty Gamma Globulinovi určitú úroveň.
S pomocou spôsobu elektroforézy sa môžu rozdeliť rôzne proteínové sérové \u200b\u200bfrakcie a určiť, ktoré frakcie globulínov zahŕňajú protilátky.
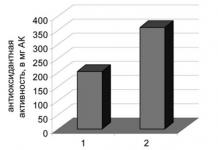
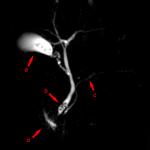
Zistilo sa teda, že protilátky patria k rôznym globulinovým frakciám - od gamy na alfa (to sú imunoglobulíny) (obr. 5).
Obr. 5. IMUNOELEKTRUKTROFOREZÁCIA NORMÁLNEHO KRVUMENTU.
Protilátky, ktoré sú vytvorené v tele s rôznymi infekciami, očkovanie, vo väčšine prípadov sa vzťahujú na gamma globulín s molekulovou hmotnosťou až 180 000. V prvej fáze produktov protilátok sa nachádzajú makrobulíny s molekulovou hmotnosťou až 900 000. Hlavným vlastníctvom Protilátky sú ich schopnosť spojiť sa s antigénmi. Alebo presnejšie, s určitými skupinami ich molekúl, ktoré spôsobili tvorbu protilátok. Chemická štruktúra týchto zoskupení s antigénnou špecifickosťou je stále neznáma. Predpokladá sa, že špecificita protilátok je určená množstvom polypeptidov alebo tri až štyroch molekúl cukrov.
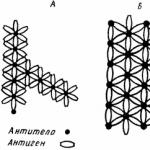
"Plot" protilátok molekúl, ktorý hrá úlohu v reakcii antigénu - protilátky, je veľmi malý. Moderné imunologické výskumné metódy (difúzia, elektroforéza, ultracentrifugácia) umožnilo stanoviť, že väčšina imunitných protilátok má dve špecifické "pozemky" na každej molekule, s ktorým je protilátka pripojená k špecifickému antigénu, je protilátka valencia. Stupeň príťažlivosti antigénu a protilátok je spôsobený elektrostatickými a intermolekulovými silami, ktoré majú makromolekuly, ako aj iní: sily Coulon, van der Waals sily, ako aj vodíkové väzby a Covalence. To všetko definuje charakteristickú štruktúru proteínovej molekuly.
Antigénová reakcia - protilátka prebieha veľmi rýchlo. Odhaduje sa, že kompletná proteínová zlúčenina a antioproteín sa vyskytuje v priebehu niekoľkých sekúnd pri 0 °.
Tvorba komplexu antigén protilátky je spôsobená dvojitou valenciou protilátok a polyvalencia antigénu. Podľa ukážky, reakcia medzi dvojmožiarskymi a polyvalentnými molekulami vedie k tvorbe zlúčeniny, ktorých rozmery sa neustále zvyšujú, pretože nové molekuly sú spojené - konglomeráty sa vytvárajú, počet hydrofilných skupín, z ktorých sa znižuje, čím sa formuluje nerozpustné zrazení.
Preventiačná reakcia je veľmi špecifická as mnohými metódami, je možné nielen detekovať trancipitické protilátky v sére, ale aj na určenie ich úrovne.
Mechanizmus aglutinačnej reakcie má veľa spoločného s mechanizmom reakcie zrážania. Antigén v týchto reakciách sú baktérie, rovnomerné krvné prvky, ako aj inertné častice, potiahnuté rozpustným antigénom zhora. S touto reakciou sú protilátky pripojené k antigénom na povrchu buniek a častíc.

Obr. 6. Schéma komplexu je antigén - protilátka. A - zóna nadbytku antigénu; B - bod rovnocennosti; B - Zóna Prebytočné protilátky.
V dôsledku bivalencie protilátky je každá molekula protilátky spojená s dvoma časticami antigénu, ktoré tvoria most medzi nimi (obr. 6), zatiaľ čo bunky alebo častice sú aglutinizované. Reakcia aglutinácie je prísne špecifická.
Existuje mnoho spôsobov aglutinálnej reakcie, s ktorým je možné určiť hladinu aglutinačných protilátok v sére. Tieto reakcie majú vysokú citlivosť a dostatočnú presnosť. V sérologických reakciách najväčší chov imunitného séra, ktorý poskytuje aglutináciu mikrobiálnymi telesami alebo krvnými bunkami váženými v roztoku fyziologického roztoku. V imunológii položili nepriamu reakciu, pri použití normálnych jahniat alebo ľudských erytrocytov, ktoré sú stanovené antigénom. Erytrocyty môžu byť usporiadané na inertných časticiach: latex, kolódium, polyster atď. Určite najväčšie riedenie séra, ktoré poskytuje viditeľnú aglutináciu. Rôzne modifikácie aglutinálnej reakcie môžu určiť protilátky pri veľmi nízkych hladinách - až 0,005 ug dusíka protilátka proteínu v 1 ml.
Vo vývoji alergických reakcií typu bezprostredného aj pomalého pohybu možno rozlíšiť tieto stupne (A. D. ADO):
- 1) Fáza imunitných reakcií;
- 2) Fáza pizikových porúch;
- 3) Fáza patofyziologických porúch.
Stupeň imunitných reakcií
Stupeň imunitných reakcií sa vyznačuje akumuláciou v tele protilátok špecifických pre tento alergén. Počiatočné fázy vývoja alergickej reaktivity sú do značnej miery pripomenuté proces imunitného rozvoja (teda a názov "štádium imunitných reakcií"), a to, alergén je upevnený v bunkách retikulosendotelového systému a spôsobuje plazme lymfoidných buniek . V druhom prípade začne tvorba protilátok. Alergické protilátky, ako aj imunitné, majú vysoký stupeň špecificity, t.j. sú spojené len s alergénom, ktoré spôsobili svoje vzdelanie. Alergické protilátky sa nachádzajú v globulínových frakciách sérových proteínov. Miesto a mechanizmus tvorby alergických protilátok sa v podstate nelíšia z tých pre imunitné protilátky. Vzhľad v tele špecifických alergických protilátok a určuje stav senzibilizácie, t.j. vznik zvýšenej citlivosti na niektoré alergény Y (z Lat. Sensebilis je citlivý). Rozlišovať senzibilizáciu aktívny a pasívny .
Aktívna senzibilizácia Nachádza sa, keď je alergén zavedený do organizmu zvieraťa s parenterálnym spôsobom (intramuskulárne, subkutánne, v podložkách labiek, v brušnej dutine, do cerebrospinálnej tekutiny, inhalácie atď.). Pre senzibilizáciu je veľmi malé množstvo alergénu určité množstvo stotín a tisíce gramov (obr. 14). Stav zvýšenej citlivosti dochádza bezprostredne po injekcii alergénu a po 10-14 dňoch zostáva u zvierat počas 2 mesiacov a viac a potom postupne zmizne. Ľudská senzibilizácia môže pretrvávať mnoho mesiacov a rokov.
V procese senzibilizácie je vyvýšená fagocytová aktivita retikulosendial systémových buniek buniek, začne plazma lymfoidných buniek a protilátky v nich začínajú.
Od prvých dní senzibilizácie v kmeňoch somatických a vegetatívnych nervov sa pozorovalo zvýšenie excitability, funkčnej mobility na N. E. Vveenskom, skrátenie chronaccia. Receptory vnútorných orgánov a krvných ciev podstúpia fázové zmeny, čo je pôvodne rastúci, a v budúcom utláčaní.
Pasívna senzibilizácia Vyskytuje sa, keď je sérum zavedené so zdravým zvieraťom iného účinného senzibilizovaného zvieraťa (pre 5-10 ml morčatá, pre králik 15 až 20 ml). Stav zvýšenej citlivosti nastáva po 18-24 hodinách po podaní séra. Tento čas je potrebný tak, aby sa protilátky obsiahnuté v cudzích sérum podarilo byť upevnené v telesných tkanivách.
Je možné pasívne senzibilizovať orgány (črevá, maternice, pľúca atď.), Umiestňujte ich v stredu s protilátkami; Zavedenie hotových protilátok v koži spôsobuje jeho lokálnu pasívnu senzibilizáciu.
Vlastnosti alergických protilátok
Alergické protilátky sú modifikované krvné globulíny. Najdôležitejšie biologické vlastnosti sú:
- ale) imunologická špecificita, t.j. schopnosť presne spojiť s alergénom, čo spôsobilo produkciu týchto protilátok;
- b) schopnosť po zlúčenine s alergénom spôsobujú určité alergické reakcie.
Všetky alergické protilátky môžu byť rozdelené do dvoch skupín:
- 1) fixné (alebo bunkové) protilátky, úzko spojené s bunkami a účasti na alergických reakciách pomalého typu;
- 2) voľné (alebo cirkulujúce) protilátkySpoločnosť bola založená v krvi a ďalších biologických tekutinách tela a spôsobujú okamžite alergické reakcie.
Cirkulujúce protilátky deleno precipitáciu a necel . Ten zahŕňa takzvané reagujúce blokujúce protilátky a niektoré ďalšie.
Vyzrážané protilátky (IgG) sa nachádzajú v krvi pri ľudskom sérovej chorobe, anafylaktický šok človeka a zvieraťa, alergického zápalu u králikov (fenomén Artus), alergické reakcie na vaječný proteín, konské lupiny a niektoré iné alergické reakcie. Precipitín termostatom.
Reaktivujte alebo kožu - senzibilizujúce protilátky IgE sa objavuje v sére pacientov s opelinózou alebo atonickou bronchiálnou astmou. Reaktory nie sú detekované s použitím bežných sérologických reakcií v testovacej trubici (zrážanie, viazanie komplementu atď.), Ale môžu pasívne senzibilizovať kožu zdravého človeka a boli pomenované s protilátkami senzibilizačnými kožami. Najspoľahlivejším spôsobom detekcie reaktorov je reakcia Praushnitz-Cupener (reakcia pasívnej senzibilizácie kože). Sérum alergického pacienta v množstve 0,05-0,1 ml sa zavádza súčasne zdravým človekom. Po dni sa zavádza špeciálne vybraná dávka alergénu na rovnaké miesto. V prípade pozitívnej reakcie, dochádza k hyperémie, opuchu, svrbenie (obr. 14).
Termolabilné reaguje, ich aktivita sa výrazne zníži po zahriatí séru na 56 ° C počas 2-4 hodín. Najdôležitejšou biologickou vlastnosťou reaktorov je ich "bispecififikácia", t.j. schopnosť spojiť sa na jednej strane, s bunkou citlivého zvieraťa, na druhej strane, s antigénom. Je to spôsobené fixáciou na bunkách a sa prejavuje škodlivá schopnosť reaktorov.
Pevné alebo bunkové, protilátky Zúčastnite sa mechanizmu pomalých alergií. Na základe skutočnosti, že pomalé alergie môžu byť dopravované do iného zvieraťa alebo osoby len s pomocou buniek (lymfocytov) senzibilizovaného organizmu, záver sa uskutočnil, že protilátka spôsobená alergikou s pomalým typom by mala byť obsiahnutá v bunkách. Niekedy sa nazýva "Prenos faktor" senzibilizácie. Tento faktor je vyňatý z senzibilizovanej bunky (lymfocytov a iných buniek) a cez kvapalné tkaniny médiá spadá do iných buniek. Tým, že ovplyvňuje ich, spôsobuje, že stav senzibilizácie v nich opäť oslobodený od nich a senzitizuje nasledujúce bunky. Týmto spôsobom môže malé množstvo alergénu senzibilizovať veľký počet buniek. Povaha prenosového faktora je určite známa. Sú známe iba niektoré z jeho vlastností; U ľudí je rezistentné voči pôsobeniu RNA-ASE, DNA-ASE, trypsín, je schopný pohybovať sa cez dialyzačnú membránu, má molekulovú hmotnosť približne 10 000.
Štádium pizikových zmien a doplnení
Ak sa v senzibilizovaných (t.j. obsahujúce alergické protilátky), telo sa znovu zavádza špecifickým alergénom, potom sa fyzikálno-chemická reakcia vzniká medzi protilátkami a alergénami a vytvára sa makromolekulárny komplex alergénovej protilátky. Upevnenie v tkanivách, tento komplex spôsobuje množstvo zmien metabolizmu. Po prvé, množstvo kyslíka absorbovaného tkanivami sa zmení, je to fázový znak (prvé zvýšenie, potom zníženie).
Pod vplyvom komplexu alergén-protilátky dochádza k tkanivovému a bunkovej proteolytické a lipolytické enzýmy, čo vedie k porušeniu funkcií zodpovedajúcich buniek. Napríklad dôsledok poškodenia tukových buniek spojivového tkaniva, krvných leukocytov (najmä bazofilov a neutrofilov) je uvoľňovanie histamínu, serotonínu a niektorých ďalších biologicky účinných látok.
Histamín. V ľudskom tele a zvieracích zvieratách je histamín obsiahnutý v tukových bunkách spojivového tkaniva, krvných basophilov, v menšej miere - v neutrofilných leukocytoch, krvných doštičkách, hladkých a priečnych svalov, pečeňových buniek, epitelu gastrointestinálneho traktu atď.
Účasť histamínu v mechanizme alergií je vyjadrená v tom, že spôsobuje spazmus hladkých svalov (napríklad bronchiole, maternice, čriev, atď.) A zvyšuje priepustnosť krvných kapilár, vďaka opuchu, urtikárii, petechia atď. Okrem toho histamín zvyšuje hydrofilitu vlákien voľného spojivového tkaniva, čo prispieva k väzbe vody v tkanivách a výskytu rozsiahleho edému typu typu napučania (obr. 15).

Histamín sa podieľa na mechanizmoch takýchto alergických reakcií u ľudí, ako svrbenie, urtikária, krátkodobé hypotepy. Hypotenzné reakcie typu kolapsu (alebo šoku) sú s najväčšou pravdepodobnosťou účasť kinínov (Bradykin) a pretrvávajúci bronchospazmus (s bronchiálnou astmou) - pôsobením na bronchiálnom strome tzv. S pomalej reakčnej látky.
Pomaly reaguje alergiu substanciu (MRS-A). Je to látka, chemická štruktúra v blízkosti kyseliny neuraminovej alebo glukozidov týchto kyselín. Táto látka spôsobuje pomalé zníženie hladkých svalových telies na rozdiel od rýchleho zníženia spôsobené histamínom. MRC-A spôsobuje, že kŕč bronchiole človeče, jeho aktivita nie je potlačená antihistaminickými látkami a proteolytickými enzýmami. Mourning miesto s alergickými reakciami sú tukové bunky spojivového tkaniva. Predpokladá sa, že táto látka má veľký význam pri výskyte bronchospazmu pri bronchiálnej astme u ľudí.
Serotonín (5-oxitriptamín) - obsahujú takmer všetky tkanivá tela, ale najmä veľa z nich v tukových bunkách spojivového tkaniva, slezinových buniek, krvných doštičiek, agenofilných a enterochromafínových buniek žalúdka, pankreasu, v niektorých nervových bunkách, najmä v hypotalamsku.
Informácie o účasti serotonínu na alergických reakciách je skôr protichodné. V experimentoch na zvieratách sa zistilo, že morčatá, mačky, potkany spôsobujú bronchospazmus. U potkanov a myší je serotonín vyňatý z tukových buniek pod vplyvom vaječného proteínu, dextránu a niektorých ďalších látok. K dispozícii je ostrý opuch tváre, vajíčok, labky (anafylaktoidná reakcia).
V alergických reakciách osoby, serotonín nemá významnú hodnotu.
Bradykin - Polypeptid pozostávajúci z 9 aminokyselín (Arginyl-sher-shed-glycil-fenylalanyl-serilnej shed-fenylalanyl arginín). Je vytvorený z alfa-2-globulínovej krvi pod vplyvom proteolytických enzýmov. V anafylaktickom šoku sú proteolytické enzýmy aktivované v dôsledku účinkov komplexu alergénu protilátky na bunkovom proteáze, ako je Callidin, Callipelin.
Bradykinis sa podieľa na patogenéze anafylaktického šoku u ľudí a zvierat: rozširuje krvné kapiláry, zvyšuje ich priepustnosť, znižuje tón arteriólu a spôsobuje hypotenziu.
Heparín - kyslý mukopolysacharid, obsahuje veľa v granúl tukových buniek. Uvoľňovanie heparínu z tukových buniek a tok jej do krvi sa pozorovalo u psov s anafylaktickým a peptonovým šokom, ako aj v injekciách v krvi látok spôsobujúcich oslobodenie histamínu. Zároveň sa z koagulácie krvi spomaľuje u psov. Ostatné zvieratá (králiky, morčatá, potkany) Krvnica krvi sa nemenia. Účasť heparínu v ľudských alergických reakciách bola študovaná málo.
Acetylcholín - Vo voľných a súvisiacich tkanivových proteínoch je obsiahnuté v takmer všetkých orgánoch. Zúčastňuje sa na mechanizme alergických reakcií najmä z týchto orgánov a tkanív, kde cholinergné reakcie sa priamo podieľajú na normálnych fyziologických procesoch (napríklad synaptických väzieb autonómneho a centrálneho nervového systému, inerváciu srdca, čriev atď. ). V procese senzibilizácie aktivity haloinsterázy tkanív a zmeny krvi zmien a s prípustným podávaním alergénu je zvýšená výnimka z acetylcholínových tkanív.
Fáza patofyziologických zmien
Patofyziologický stupeň alergických reakcií je konečnou expresiou tých imunitných a pichľavých procesov, ku ktorým došlo po zavedení špecifického alergénu v senzibilizovanom organizme. Vyvíja sa z reakcie poškodenými bunkami buniek, tkanív, orgánov a tela ako celku.
Alergické poškodenie jednotlivých buniek Dobre študoval na príklad červených krviniek, krvných doštičiek, krvných leukocytov, buniek spojivového tkaniva - histiocytov, tukových buniek atď. Poškodenie sa aplikuje na nervové a hladké svalové bunky, srdcové svalstvo atď.
Reakcia každej z poškodených buniek je určená svojimi fyziologickými vlastnosťami. Takže v nervovej bunke je elektrický potenciál poškodenia, v myofibrilách hladkých svalov - kontraktúra; Erytrocyty sú podrobené hemolýze. Poškodenie leukocytov je vyjadrené redistribúciou v protoplazme glykogénu, pri lýze. Zrnité bunky napučiavajú a vyhadzujú svoje granuly - vyskytuje sa degranulácia buniek. Posledný proces je obzvlášť ostro vyslovovaný v bazofiloch krvi a tukových buniek voľného spojivového tkaniva, ktorého granuly sú obzvlášť bohaté na rôzne biologicky účinné látky, ktoré sú alergickými reakčnými mediátormi (obr. 16).

Alergické poškodenie tkaniva a orgánov Vyskytuje sa v dôsledku poškodenia buniek, ktoré tvoria toto tkanivo, na jednej strane, a v dôsledku zhoršenej nervovej a humorálnej regulácie funkcií týchto orgánov, na strane druhej. Takže kontrakt s hladkými svalymi malých bronchi dáva bronchospazmus a znižuje lúmenu dýchacích ciest. Avšak, v komplexnom mechanizme respiračného pôsobenia s bronchiálnou astmou (výskyt exspiračného dychu), je tu tiež zmena excitability dýchacieho centra a citlivých nervových zakončení putovacieho nervu, v stenách alveolu ( Porušenie rozlíšeného reflexu Breilera) a intenzívnej sekrécie hlienu, blokovania bronchiole a expanzných kapilár, ktoré zvyšujú alveoli a zvyšujú priepustnosť kapilárnych stien.
Rozšírenie krvných ciev a zvýšenie priepustnosti kapilár, čo vedie k ohrevu kvapalnej časti krvi v tkanive a výsledný výskyt mestskej časti, opuchy, závisí od akcie na plavidlách alergických mediátorov (histamín , serotonín), takže z poruchy periférnej a centrálnej regulácie vaskulárneho tónu. Celkové expresie patofyziologickej fázy alergických reakcií je reakcia tela všeobecne, určité alergické ochorenia alebo alergické syndrómy.